
 金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出热量如图所示.
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出热量如图所示.分析 (1)依据物质能量越高,物质越不稳定;依据图象判断石墨的燃烧热;
(2)依据极值计算判断生成的气体组成,结合热化学方程式计算得到;
(3)旧键断裂吸收的能量减去新键生成释放的能量值即为化学反应所吸收的能量,结合N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,N2(g)+O2(g)=2NO(g),△H=+180kJ•mol-1可以计算NO分子中化学键的键能;
(4)利用盖斯定律结合已知热化学方程式计算反应热,再写出热化学方程式.
解答 解:(1)图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为393.5kJ?mol-1;
故答案为:石墨;-393.5kJ?mol-1;
(2)12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 ;C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1
生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ•mol-1 ×0.5mol+110.5 kJ•mol-1 ×0.5mol=252KJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ;
故答案为:252.0 kJ;
(3)根据N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1可设NO分子中化学键的键能为X,则有:946kJ•mol-1+497kJ•mol-1-2X=180kJ•mol-1 得:X=631.5kJ•mol-1,
故答案为:631.5kJ•mol-1;
(4)已知①C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 ;
②C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1;
③N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1;
由盖斯定律:方程式①×2-②×2-③得 2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.0kJ?mol-1;
故答案为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.0kJ?mol-1.
点评 本题考查了化学反应的能量变化与反应的焓变关系的分析判断,为高频考点,侧重考查学生的分析能力和计算能力,注意把握图象的综合应用,读懂图象,焓变和活化能计算方法的理解是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 都是直线形结构 | |
| B. | 中心原子都采取 sp1杂化 | |
| C. | 硫原子和碳原子上都没有孤对电子 | |
| D. | SO2 为 V 形结构,CO2为直线形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质(杂质) | 除杂质所用试剂及方法 |
| A | 乙醇(水) | 加入生石灰蒸馏 |
| B | 苯(苯酚) | 加入浓溴水振荡后过滤 |
| C | 溴乙烷(溴单质) | 加入NaHSO3溶液振荡、静置、分液 |
| D | 甲烷(乙烯) | 依次通过KMnO4酸性溶液、NaOH溶液洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
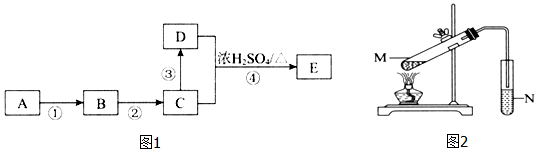
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
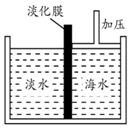 海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.
海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.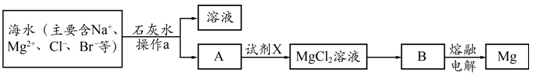
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com