
【题目】一定条件下,可逆反应2A![]() B+3C,在以下四种情况中处于平衡状态的是( )
B+3C,在以下四种情况中处于平衡状态的是( )
正反应速率 | 逆反应速率 | |
A | v(A)=2 mol·L-1·min-1 | v(B)=2 mol·L-1·min-1 |
B | v(A)=2 mol·L-1·min-1 | v(C)=2 mol·L-1·min-1 |
C | v(A)=1 mol·L-1·min-1 | v(B)=2 mol·L-1·min-1 |
D | v(A)=1 mol·L-1·min-1 | v(C)=1.5 mol·L-1·min-1 |
A. A B. B C. C D. D
【答案】D
【解析】化学反应到达平衡时,同一物质的正逆反应速率相等;A.A物质的正反应速率υA=2mol/(l·min),逆反应速率υB=2mol/(l·min),则逆反应速率υA=4mol/(l·min),A的正逆反应速率不相等,所以该反应未达到平衡状态,故A错误;B.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是2mol/(L·min),C的逆反应速率为2mol/(L·min),A的逆反应速率为![]() mol/(L°·min),所以A的正逆反应速率不等,故B错误;C.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L·min),B的逆反应速率为2mol/(L·min),A的逆反应速率为4mol/(L·min),所以A的正逆反应速率不等,故C错误;D.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L·min),C的逆反应速率为1.5mol/(L·min),A的逆反应速率为1mol/(L·min),所以A的正逆反应速率相等,故D正确;故选D。
mol/(L°·min),所以A的正逆反应速率不等,故B错误;C.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L·min),B的逆反应速率为2mol/(L·min),A的逆反应速率为4mol/(L·min),所以A的正逆反应速率不等,故C错误;D.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L·min),C的逆反应速率为1.5mol/(L·min),A的逆反应速率为1mol/(L·min),所以A的正逆反应速率相等,故D正确;故选D。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 硫粉在过量的纯氧中燃烧可以生成大量的SO2
B. 可以用品红溶液鉴别SO2和CO2
C. SO2能使品红溶液、酸性KMnO4溶液褪色,但褪色原理不同
D. 少量SO2通过CaCl2的溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·江苏化学,14,4分)25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是(双选)( )
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH![]() )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:![]() c(Na+) =c(CO
c(Na+) =c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国南方,遭遇冰雪灾害时常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为元素周期表前20号元素,X的阳离子和Y的阴离子电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是__________________,该物质中化学键类型是________________,电子式是__________________
(2)D、E元素原子的最外层电子数是其电子层数的2倍,D与Y相邻,则元素D的阴离子结构示意图是________________。D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的电子式为____________________。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质与W的单质加热时生成物中化学键类型为__________,电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题:
(1) 上述实验中发生反应的化学方程式有:
__________________、_____________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________;
(3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________;
(4) 要加快上述实验中气体产生的速率,还可以采取的措施有:
_____________________、___________________________(举两种)。
(5) 为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下的一系列的实验。将表中所给的混合溶液分别加到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需要的时间。
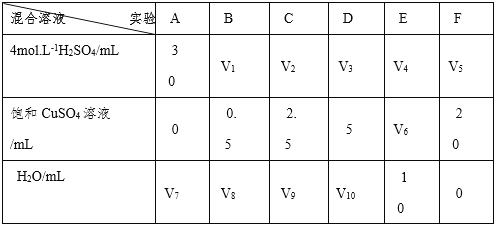
①请完成此实验设计,其中:V1 =____;V6 = ____;V9=____;
②反应一段时间后,实验E中的金属呈____色;
③该同学最后得出结论为:当加入少量硫酸铜溶液时,生成氢气的速率会大大提高,但当加入的硫酸铜溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:______________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 共价化合物中可能含有离子键
B. Ca2+、K+、Cl-、S2-四种离子的半径依次减小
C. ![]() Po、
Po、![]() Po、
Po、![]() Po三种原子的核外电子数分别为124、125、126
Po三种原子的核外电子数分别为124、125、126
D. ⅥA族元素氧、硫、硒(Se)的位置从上至下,故H2O、H2S、H2Se稳定性依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com