
 Na2SO4+MnSO4+Cl↑+2H2O。③KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化浓盐酸。④电解熔解NaCl或电解饱和食盐水。
Na2SO4+MnSO4+Cl↑+2H2O。③KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化浓盐酸。④电解熔解NaCl或电解饱和食盐水。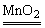 2H2O+O2↑;B项无化学反应发生;C项中2KClO3
2H2O+O2↑;B项无化学反应发生;C项中2KClO3

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (选做题)
(选做题)| 45V |
| 28 |
| 45V |
| 28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)Ⅰ、(1)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵,则①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)已知某温度下,纯水中的C(H+)=5×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
Ⅱ、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g)![]() 2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是 热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为 。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g) 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com