
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
欲除去混入甲烷中的乙烯,得到纯净的甲烷,最好依次通过装有什么试剂的洗气瓶( )。
A.澄清石灰水、浓硫酸 B.酸性高锰酸钾溶液、浓硫酸
C.溴水、浓硫酸 D.浓硫酸、酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某燃煤发电厂处理废气的装置示意图,下列说法错误的( )
A.使用此废气处理装置可减少酸雨的形成
B.装置内发生的反应有化合、分解、置换和氧化还原反应
C.整个过程的反应可表示为: 2SO2+2CaCO3+O2=2CaSO4+2CO2D.若烟囱的气体排放不达标,则此气体可使酸性高锰酸钾溶液褪色
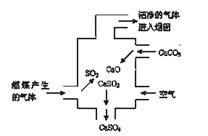
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用如图中的装置可以实现该反应。
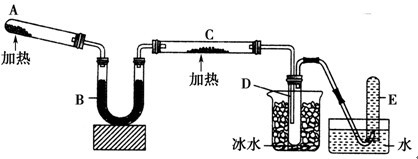
回答下列问题:
(1)A中发生反应的化学方程式是__________________________。
(2)B中加入的干燥剂是(填序号)___________①浓硫酸 ②无水氯化钙 ③ 碱石灰
(3)能证明氨与氧化铜反应的现象是①C中___________________,②D中有无色液体生成设计实验检验D中无色液体的成分:取少量 粉末,现象为________________________________。
(4) 写出氨气与氧化铜反应化学方程式_________________若收集到2.24L(STP)氮气,计算转移电子数为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R是1~18号元素中的四种元素,它们的原子结构有以下特点:
①元素X原子的M层比L层少3个电子;
②元素Y的2价阴离子的核外电子排布与氖原子相同;
③元素Z原子的L层比M层多5个电子;
④元素R原子的L层比K层多3个电子,其中金属性最强的是( )
A.X B.Y C.Z D.R
查看答案和解析>>
科目:高中化学 来源: 题型:
在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素,对延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物化学式为RO3,则R元素的名称为( )
A.硫 B.砷 C.硒 D.硅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质分类的说法正确的是
A.金刚石、白磷都属于单质 B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质 D.葡萄糖、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个电子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:
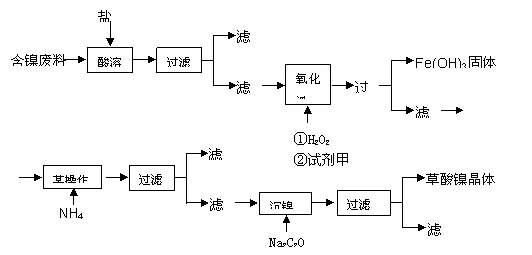

(1)加6%的H2O2时,温度不能太高,其目的是 。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况 。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH= 。
(3)流程中加入NH4F的目的是 。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式 。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式 ;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6  LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com