
| A. | 化学反应速率可用某时刻生成物的物质的量浓度的增加来表示 | |
| B. | 在同一反应中,用各种物质表示的化学反应速率的大小相等 | |
| C. | 化学反应速率是指单位时间内反应物浓度的减少或生成物浓度的增加 | |
| D. | 若反应现象在短时间内出现,则反应速率快,反应现象若不出现,则该反应速率一定慢 |
分析 A.化学反应速率只能是某一段时间内的平均反应速率,不是瞬时反应速率;
B.同一反应中用反应物或生成物表示的化学反应速率和化学方程式计量数有关;
C.化学反应速率是用单位时间内反应物浓度减小或生成物浓度增加表示;
D.没有明显反应现象,反应速率不一定慢,如酸碱中和反应.
解答 解:A.化学反应速率表示单位时间内反应物浓度的减少或生成物浓度的增加,化学反应速率为平均反应速率,不是瞬时反应速率,故A错误;
B.同一反应中用反应物或生成物表示的化学反应速率和化学方程式计量数有关,速率之比等于化学方程式计量数之比,数值可能不同,但表示意义相同,故B错误;
C.化学反应速率是用单位时间内反应物浓度减小或生成物浓度增加表示,该说法合理,故C正确;
D.判断反应快慢应看其反应速率,有些反应几乎没有现象例如盐酸和氢氧化钠反应,反应速率较快,但观察不到现象,故D错误;
故选C.
点评 本题考查化学反应速率的概念、反应速率与反应现象的关系,题目难度不大,试题侧重看基础知识的考查,注意明确化学反应速率的概念及应用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol H2中含有的电子数为2NA | |
| B. | 22.4L氧气所含的氧原子数为2NA | |
| C. | 常温常压下,28g氮气所含的原子数为NA | |
| D. | 2g氢气所含的氢原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g Fe粉与足量的稀硝酸完全反应,失电子总数为0.2NA | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 17g氨气中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性、漂白性 | B. | 酸性、漂白性 | C. | 只有酸性 | D. | 只有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | Cs是第ⅠA族元素,Cs失电子能力比Na的强 | |
| C. | 砹(At)是第VIIA族,其氢化物的稳定性大于HCl | |
| D. | 第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
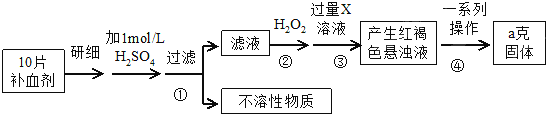
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

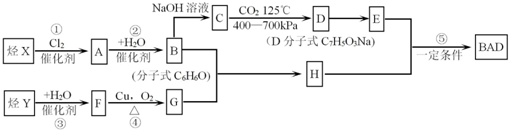
 .
. .
.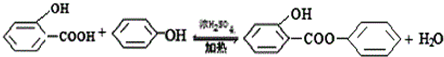 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com