
分析 (1)发生反应为:Zn+2HCl═ZnCl2+H2↑、Fe+2HCl═FeCl2+H2↑,根据n=$\frac{V}{{V}_{m}}$计算出生成氢气的物质的量,然后利用质量守恒定律可计算出消耗HCl的物质的量,最后根据V=$\frac{n}{c}$计算出消耗盐酸的体积;
(2)设出混合物中锌、铁的物质的量,分别根据金属总质量、生成氢气的物质的量列式计算.
解答 解:(1)标准状况下4.48L氢气的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,根据反应Zn+2HCl═ZnCl2+H2↑、Fe+2HCl═FeCl2+H2↑可知,消耗HCl的物质的量为:n(HCl)=2n(H2)=0.2mol×2=0.4mol,
所以该反应中消耗盐酸的体积为:$\frac{0.4mol}{2mol/L}$=0.2L=200mL,
答:反应中消耗盐酸的体积为200mL或0.2L;
(2)设Zn、Fe的物质的量分别为x、y
由Zn+2HCl═ZnCl2+H2↑、Fe+2HCl═FeCl2+H2↑可知关系式:Zn~2HCl、Fe~2HCl,
则:$\left\{\begin{array}{l}{65x+56y=12.1}\\{x+y=0.2}\end{array}\right.$,解得:x=0.1mol、y=0.1mol,
答:该混合物中锌、铁的物质的量都为0.01mol.
点评 本题考查混合物反应的计算,题目难度中等,明确金属与酸反应的化学方程式是解答的关键,并学会利用质量关系、消耗的酸来列式计算即可解答,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫化钠的水解反应:S2-+H3O+HS-+H2O | |
| D. | 将0.2 mol•L-1的NH4Al(SO4)2溶液与0.3 mol•L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此合金的熔点、硬度比镁和铝的熔点、硬度都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 比合金不能全部溶解于过量Fe2Cl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含共价键的离子化合物 | |
| B. | 在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 | |
| C. | HI的相对分子质量比HF大,所以HI的沸点比HF高 | |
| D. | H与D、16O与18O互为同位素;H216O、D216O、H218O、D216O互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
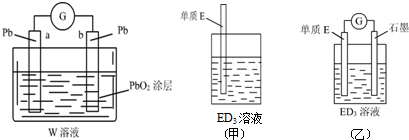
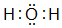 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使酸性KMnO4褪色:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| B. | Fe(OH)2与HNO3溶液的反应:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 足量NaOH与磷酸二氢铵反应:OH-+NH4+=NH3•H2O | |
| D. | 将SO2通入BaCl2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com