
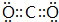 ;用电子式表示化合物 C2D 的形成过程
;用电子式表示化合物 C2D 的形成过程 .
. 分析 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大.已知A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在点燃时与足量的B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素,据此解答.
解答 解:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大.已知A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在点燃时与足量的B单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素,
(1)通过以上分析知,A是碳,B是氧,C是钠,D是硫,
故答案为:碳;氧;钠;硫;
(2)CO2分子中碳原子与氧原子形成2对共用电子对,电子式为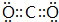 ,C2D是硫化钠,由钠离子与硫离子构成,硫化钠电子式为
,C2D是硫化钠,由钠离子与硫离子构成,硫化钠电子式为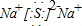 ,用电子式表示其形成过程为:
,用电子式表示其形成过程为: ,
,
故答案为: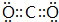 ;
; .
.
点评 本题考查结构性质位置关系应用,侧重对电子式的考查,注意掌握电子式表示化学键或物质的性质过程.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫是一种黄色晶体,易溶于水 | |
| B. | 新制氯水应避光保存 | |
| C. | 新制氯水具有漂白作用 | |
| D. | 二氧化氮是红棕色、有刺激性气味的有毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
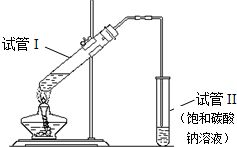 用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题:
用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 能量转化形式 |
| ①CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | 由 化学能转化为 热能 |
| ②Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | 由 化学能转化为 电能 |
| ③CaCO3$\frac{\underline{\;高温\;}}{\;}$Ca+CO2↑ | 由 热能转化为 化学能 |
| ④6nH2O+6nCO2$→_{叶绿素}^{光}$(C6H12O6)n+6nO2 | 由 光能转化为 化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验结论 |
(1)A的质谱图如下: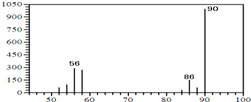 | (1)证明A的相对分子质量为90. |
| (2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: C3H6O3. |
| (3)另取两份9.0g A分置于不同的试管中.往其中一份A中加入足量的NaHCO3粉末充分反应,生成2.24 L CO2(标准状况). 往另一份A中加入足量金属钠充分反应,生成2.24 L H2(标准状况). | (3)证明A的分子中含有羧基和羟基官能团. |
(4)A的核磁共振氢谱如图: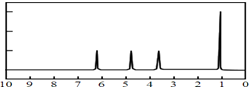 | (4)A的结构简式为: . . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与钠反应① | B. | 在铜催化下加热①③ | ||
| C. | 在浓硫酸170°C条件下加热②③ | D. | 与HCl反应生成氯乙烷② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与
与
 与
与
 与
与
 与
与
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com