
【题目】A、B、C、D、E五种化合物中均含有地壳中含量最多的金属元素,它们的转化关系如图所示,其中A为澄清溶液,B、C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
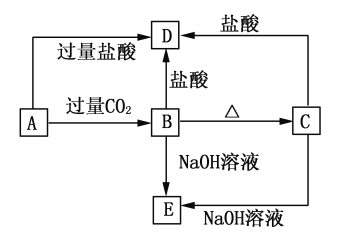
(1)写出化学式:A________,B________,C________,D________,E________。
(2)写出下列反应的离子方程式:
A→B:_____________________
A→D:_____________________
【答案】(1)KAlO2 Al(OH)3 Al2O3 AlCl3 NaAlO2(每空1分)
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
AlO2-+4H+=Al3++2H2O(每空2分)
【解析】
试题分析:B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,则A应为KAlO2,
(1)通过以上分析知,A、B、C、D、E分别是KAlO2、Al(OH)3、A12O3、AlCl3、NaAlO2;
(2)A→B的反应为AlO2-和Al(OH)3的转化,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
A→D的反应为AlO2-和Al3+的转化,反应的离子方程式为AlO2-+4H+=Al3++2H2O。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.常温常压下,46 g NO2与N2O4的混合气体中含有的分子总数为NA
B.0.1 mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA
C.25 ℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
D.一定量的钠与8 g氧气作用,若两者均无剩余,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中不能用化合反应的方法制得的是
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3 ⑤FeCl2 ⑥ CaSiO3
A.①③ B.②④ C.②③④ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中,充入一定量的H2和SO2发生下列反应:3 H2(g) + SO2(g)![]() 2 H2O(g) + H2S(g),下列说法正确的是( )
2 H2O(g) + H2S(g),下列说法正确的是( )
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
H2 | SO2 | H2 | SO2 | ||
容器Ⅰ | 300 | 0.3 | 0.1 | 0.02 | |
容器Ⅱ | 300 | 0.6 | 0.2 | ||
容器Ⅲ | 240 | 0.3 | 0.1 | 0.01 | |
A.该反应正反应为吸热反应
B.容器Ⅲ达到平衡的时间比容器I短
C.240℃时,该反应的平衡常数为1.08×104
D.容器Ⅱ达到平衡时SO2的转化率比容器I小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚11时,天津港国际物流中心区域内化学危险品仓库因起火而发生爆炸。其仓库存储的桶装氰化钠,因爆炸冲击发生了泄漏。氰化钠是一种重要的基本化工原料,用于电镀、冶金等,因此很多工业废水中也含氰化钠,此工业废水可与其他工业废水一同处理。下图是工业上处理含铬废水和含氰废水的流程图:
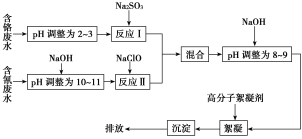
(1)含铬废水中的铬元素主要以CrO![]() 形式存在,酸化时CrO
形式存在,酸化时CrO![]() 可转化为Cr2O
可转化为Cr2O![]() ,现象是__________________________。
,现象是__________________________。
(2)酸性条件下,Cr2O![]() 极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为__________________________。
极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为__________________________。
(3)①在爆炸发生时有少量氰化钠炸出,有人指出可用双氧水处理,使之被氧化成无毒物质,已知二者反应生成一种烘焙时常用的物质,并释放出一种有刺激性气味的气体,该气体易液化,液化后常用作制冷剂,请写出氰化钠与过氧化氢反应的化学方程式:________________________。
②除双氧水外,还可用硫代硫酸钠处理氰化钠,转化为Na2SO3及弱毒性的NaSCN,写出两种物质发生反应的化学方程式:__________________。
(4)pH>10时,“反应Ⅱ”中的NaClO可将氰离子(CN-)快速氧化为两种无毒的物质,写出该反应的离子方程式:_____________________________。
(5)经过“反应Ⅰ”和“反应Ⅱ”的两种废水“混合”的目的是____________________。
向混合后的溶液中加NaOH调为碱性的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( )
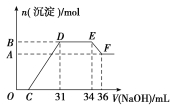
A.OC段离子反应方程式为:H++OH-===H2O
B.溶液中n(NH![]() )=0.012 mol
)=0.012 mol
C.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5molL﹣1的盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是( )
A.0.05 molL﹣1
B.0.25 molL﹣1
C.0.10 molL﹣1
D.0.50 molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com