
| A. | Ksp(CaF2)随浓度的变化而变化 | |
| B. | 上述混合体系中有CaF2沉淀生成 | |
| C. | 25℃时,0.1mol/L的HF溶液的pH=l | |
| D. | 上述反应的离子方程式为:Ca2++2F-=CaF2↓ |
分析 A.Ksp只与温度有关,与浓度无关;
B.两溶液混合后,c(Ca2+)=0.1 mol•L-1,c(F-)=$\sqrt{{K}_{a}×c(HF)}$=6×10-3mol/L,再计算浓度积Qc,与溶度积Ksp(CaF2)比较判断;
B.根据氟化钙、碳酸钙的溶度积计算出饱和溶液中溶解的碳酸钙、氟化钙的浓度;
C.HF为弱酸,不能完全电离;
D.氟化氢为弱酸,离子方程式中不能拆开.
解答 解:A.Ksp只与温度有关,则Ksp(CaF2)随温度的变化而变化,与浓度无关,故A错误;
B.两溶液混合后,c(Ca2+)=0.1 mol•L-1,c(F-)=$\sqrt{{K}_{a}×c(HF)}$=6×10-3mol/L,则Qc=c2(F-)•c(Ca2+)=(3.6×10-5mol/L)•0.1 mol•L-1=3.6×10-6>Ksp,说明有沉淀产生,故B正确;
C.HF酸为弱酸,不能完全电离,则25℃时,0.1 mol•L-1HF溶液中pH>1,故C错误;
D.氢氟酸为弱酸,离子方程式中氟化氢不能拆开,正确的离子方程式为:Ca2++2HF=CaF2↓+2H+,故D错误;
故选B.
点评 本题考查了难溶物溶解平衡及其应用,题目难度中等,明确难溶物溶解平衡的概念及影响因素为解答关键,试题培养了学生的分析能力及化学计算能力.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和烃就是烷烃 | |
| B. | 随着碳原子数的递增,烷烃的熔沸点逐渐降低 | |
| C. | 取代反应中可能有单质生成 | |
| D. | 任何烷烃分子都不可能为平面结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
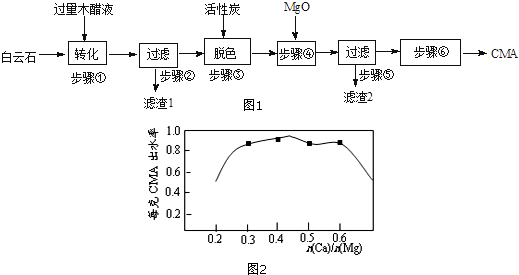
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
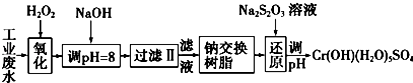
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液AG=0 | |
| B. | 常温下0.1mol/L氢氧化钠溶液的AG=12 | |
| C. | 酸性溶液AG<0 | |
| D. | 常温下0.1mol/L的盐酸溶液的AG=13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com