
(10分) (1)CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体的平均摩尔质量为 ,CH4与CO2的分子个数比为 。对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(2)现有下列6种物质:CO2、SiO2、CaO、MgO、Fe2O3、C。
按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①________________________________________②________________________________________。
(3)从上述物质中分别找出两种能相互反应的物质, 各写一个非氧化还原
各写一个非氧化还原 反应的方程式和氧化还原反应的方程式:________________________________,____________________________________
反应的方程式和氧化还原反应的方程式:________________________________,____________________________________
(4)生活中的食醋和淀粉溶液分别属于分散系中的_____和______,用___________可以鉴别(填化学专用名词)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
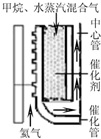 (2010?江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(2010?江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:| 1 |
| 2 |
| 气体 | 进口温度/℃ | 进口压强/MPa | 进口流量/g?s-1 | 出口流量/g?s-1 |
| 甲烷 | 464 | 4.26 | 12 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
| 高温 |
| c(CO)c3(H2) |
| c(CH4)c(H2O) |
| c(CO)c3(H2) |
| c(CH4)c(H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com