
| �� | �� | �� | �� | ||
| �ܱ��������/L | 2 | 2 | 2 | 1 | |
| ��ʼ���ʵ��� | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2��ƽ��ת����/% | 80 | ��1 | ��2 | ��3 |
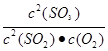 =
= 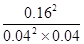 =400����ȷ��C���Һͱ��ж���������ʼ����ͬ���������������ʵ������������������ʵ��������Ԧ�1<��2�����Ͷ��ж��������������ʼŨ����ͬ��ƽ���Ч����������ת������ȣ�����D�����Ͷ�ƽ���Ч����������Ũ����ͬ�����ж��������������ʼŨ���Ǽ��ж��������������ʼŨ�ȵ�2����Ũ�ȼӱ���Ч������ѹǿ�����Ա�����������Ũ�ȴ��ڼ�����������Ũ�ȣ�����
=400����ȷ��C���Һͱ��ж���������ʼ����ͬ���������������ʵ������������������ʵ��������Ԧ�1<��2�����Ͷ��ж��������������ʼŨ����ͬ��ƽ���Ч����������ת������ȣ�����D�����Ͷ�ƽ���Ч����������Ũ����ͬ�����ж��������������ʼŨ���Ǽ��ж��������������ʼŨ�ȵ�2����Ũ�ȼӱ���Ч������ѹǿ�����Ա�����������Ũ�ȴ��ڼ�����������Ũ�ȣ�����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2013?��ɳģ�⣩2SO2��g��+O2��g��
| ||||||||||||||||||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | �� | ||
| �ܱ��������/L | 2 | 2 | 2 | 1 | |
| ��ʼ���ʵ��� | n��SO2��/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n��O2��/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2��ƽ��ת����/% | 80 | ��1 | ��2 | ��3 | |
| A�����з�Ӧ��ƽ�ⳣ��С���� |
| B�����¶��£��÷�Ӧ��ƽ�ⳣ��KΪ400 |
| C��SO2��ƽ��ת���ʣ���1����2=��3 |
| D��������SO3�����ʵ���Ũ�ȣ���=������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������ʡ��֣��ѧ�߶���ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ���ѡ��
2SO2(g)+O2(g) 2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ��
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ��
| | �� | �� | �� | |
| ��ʼ���ʵ��� | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
| n(O2) / mol | 0.24 | 0.24 | 0.48 | |
| SO2��ƽ��ת���� / % | 80 | ��1 | ��2 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ���������������и���3�½�ѧ������У�һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£��ڼס��ҡ��������ĸ������ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ��
|
|
�� |
�� |
�� |
�� |
|
|
�ܱ��������/L |
2 |
2 |
2 |
1 |
|
|
��ʼ���ʵ��� |
n(SO2)/mol |
0.4 |
0.8 |
0.8 |
0.4 |
|
n(O2)/mol |
0.24 |
0.24 |
0.48 |
0.24 |
|
|
SO2��ƽ��ת����/% |
80 |
��1 |
��2 |
��3 |
�����ж��У���ȷ����
A�����з�Ӧ��ƽ�ⳣ��С����
B�����¶��£������з�Ӧ��ƽ�ⳣ��K��Ϊ400
C��SO2��ƽ��ת���ʣ���1����2����3
D��������SO3�����ʵ���Ũ�ȣ������ף���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ�����и�����һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
2SO2(g)
+ O2(g)  2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ��
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ��
|
|
�� |
�� |
�� |
|
|
��ʼ���ʵ��� |
n(SO2) / mol |
0.4 |
0.8 |
0.8 |
|
n(O2) / mol |
0.24 |
0.24 |
0.48 |
|
|
SO2��ƽ��ת���� / % |
80 |
��1 |
��2 |
�����ж��У���ȷ���ǣ� ��
A�����з�Ӧ��ƽ�ⳣ��С����
B�����¶��£�ƽ�ⳣ��ֵΪ400
C��ƽ��ʱ������c(SO3)�Ǽ��е�2��
D��ƽ��ʱ������O2��ת���ʴ�������O2��ת����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com