
氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。

③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。
(1)① > ②c ③25% 0.05 mol/(L·min)
> ②c ③25% 0.05 mol/(L·min)
(2)①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)
ΔH=-641.5 kJ/mol
②N2H4+4OH--4e-=N2↑+4H2O
③4Cu(OH)2+N2H4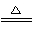 2Cu2O+N2↑+6H2O HN3
2Cu2O+N2↑+6H2O HN3
【解析】根据化学方程式可写出该反应的平衡常数表达式,该反应为放热反应,升高温度,平衡左移,平衡常数减小,故K1>K2。②当N2、H2、NH3的浓度之比为1∶3∶2时,不一定为平衡状态,a项错误;当3v(N2)正=v(H2)逆时为平衡状态,b项错误;该反应为气体体积减小的反应,当压强不变时一定达到平衡状态,c项正确;该体系中气体的质量不发生变化,容器体积不发生变化,故混合气体的密度不变,d项错误。
③设转化的N2的物质的量为x mol,则有:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始(mol) 1 3 0
转化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
根据平衡时气体的总物质的量为原来的 ,可得x=0.25,则N2的转化率为25%,
,可得x=0.25,则N2的转化率为25%,
v(NH3)=0.5/10=0.05 mol/(L·min)。
(2)①由题中信息可写出该反应的热化学方程式。②在原电池中,阳离子移向正极,故N2H4所在的电极为负极,发生氧化反应,其电极反应式为N2H4+4OH--4e-=N2↑+4H2O。③根据氧化还原反应原理及质量守恒定律可写出N2H4与Cu(OH)2反应的化学方程式;由于N2为0.3 mol,则氮气质量为8.4 g,又因叠氮酸的质量为8.6 g,则叠氮酸中氢元素的质量为0.2 g,从而可推知叠氮酸中H、N的原子个数比为1∶3,则其分子式为HN3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题1物质的组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列有关物质组成、性质和变化的说法中,正确的是( )。
A.化学变化不产生新元素,产生新元素的变化不是化学变化
B.石油的分馏、裂化、裂解和煤的干馏都属于化学变化
C.导电性属于物质的物理性质,所以物质导电时不可能发生化学变化
D.某微粒的电子数等于质子数,则该微粒可能是分子或离子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题11有机化学基础练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.溴乙烷和甲醇都能发生消去反应
B.乙烯和苯都能与酸性KMnO4溶液发生反应
C.糖类和蛋白质都是人体需要的营养物质
D.纤维素和油脂的水解产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷(解析版) 题型:实验题
某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)。

(1)MgCO3的分解产物为________。
(2)装置C的作用是_____________________________________________________,
处理尾气的方法为_______________________________________________________。
(3)将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
(已知:Fe2+与K3[Fe(CN)6]反应产生蓝色沉淀)。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是________。
②甲组步骤1中反应的离子方程式为__________________________________________。
③乙组步骤4中,溶液变红的原因为_______________________________________,
溶液褪色可能的原因及其验证方法为______________________________________
④从实验安全考虑,题图装置还可采取的改进措施是__________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 有机推断练习卷(解析版) 题型:填空题
口服抗菌药利君沙的制备原料G和某种广泛应用于电子电器等领域的高分子化合物Ⅰ的合成路线如下:

已知:①R—CH2—CH===CH2 R—CHCl—CH===CH2
R—CHCl—CH===CH2
②R—CH2—CH===CH2  R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)A的结构简式是________,D中的官能团的名称是________。
(2)写出B―→C的化学方程式:___________________________________________,
该反应类型是____________________。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,写出H的结构简式:_____________________________________________________
(4)写出E+H―→I的化学方程式:______________________________。
(5)J是比C多一个碳原子的C的同系物,J可能的稳定结构有________种(①考虑顺反异构;②“ ”结构不稳定),请任意写出其中一种的结构简式:______________。
”结构不稳定),请任意写出其中一种的结构简式:______________。
(6)关于G的说法中正确的是________(填序号)。
a.1 mol G可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G可与2 mol H2发生加成反应
d.G在一定条件下可与Cl2发生取代反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 基本概念、基本理论练习卷(解析版) 题型:填空题
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源。
(1)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为______________________。

(2)煤气化所得气体可用于工业合成二甲醚,其反应如下:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
同时发生副反应:CO(g)+2H2(g) CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
在温度为250 ℃、压强为3.0 MPa时,某工厂按投料比V(H2)∶V(CO) =a进行生产,平衡时反应体系中各组分的体积分数如下表:
物质 | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
体积分数 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
①投料比a=________;
②250℃时反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=________。
CO2(g)+H2(g)的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(解析版) 题型:填空题
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:

(1)原料Fe(NO3)n中n=________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为________。
(2)步骤二中“连续搅拌”的目的是__________________________________________
步骤三中洗涤干净的标准是________________________________________________
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4 MnFe2O4-x+O2↑;
MnFe2O4-x+O2↑;
MnFe2O4-x+xH2O MnFe2O4+xH2↑
MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为________。
②该热化学循环制氢法的优点有_____________________、________________________ (答两点即可)。
该热化学循环法制氢尚有不足之处,进一步改进的研究方向是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
25℃时,某难溶性碱MOH在水中的沉淀溶解平衡曲线如图所示(单位:mol·L-1)。下列说法正确的是( )

A.该碱在25℃时的Ksp为2×10-10
B.a点的Ksp大于b点的Ksp
C.通过蒸发可使溶液由b点变为c点
D.25℃时,要使c(M+)为0.1 mol·L-1的溶液形成沉淀,溶液的pH至少要升高到5
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:填空题
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | S | HC |
含量/(mg·L-1) | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为 mol·L-1。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。

电渗析原理示意图
①阴极的电极反应为 。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式: 。
③淡水的出口为a、b、c中的 出口。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com