
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
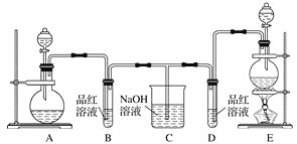
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是________(填字母),反应中浓盐酸所表现出的化学性质是________________和________________。
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,__________(填“B”或“D”)试管中无明显现象。
(3)装置C的作用是____________________。
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是__________________。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是____________________________。
【答案】E 还原性 酸性 D 吸收多余的二氧化硫和氯气 先变红,后褪色 SO2+Cl2+2H2O===2HCl+H2SO4
【解析】
(1)根据反应物的状态和反应条件选择反应装置,根据氯元素的化合价变化和生成物分析浓盐酸的性质;
(2)根据二氧化硫和次氯酸的漂白原理分析;
(3)根据二氧化硫和氯气均是大气污染物分析;
(4)根据氯水的性质分析;
(5)根据氯气能和二氧化硫在溶液中反应生成盐酸和硫酸解答。
(1)根据题给信息知,实验室制取氯气所用药品是固体和液体,反应条件是加热,所以应选用固液加热型装置,选E;实验室制取氯气的反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价降低,所以浓盐酸所表现出的性质是酸性和还原性;
MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价降低,所以浓盐酸所表现出的性质是酸性和还原性;
(2)氯气通入品红溶液中红色褪去,是利用次氯酸的强氧化性,生成的无色物质稳定,加热不复原;二氧化硫的漂白性是利用二氧化硫和有色物质化合生成无色物质,生成的无色物质不稳定,加热复原,因此D试管中无明显现象;
(3)氯气和二氧化硫均有毒不能直接排放到空气中,需进行尾气处理,装置C的作用是吸收多余的SO2和Cl2防止污染环境;
(4)氯气溶于水生成盐酸和次氯酸,氯水显酸性和强氧化性,因此若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是先变红,后褪色;
(5)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应生成盐酸和硫酸而使气体失去漂白性,反应方程式为Cl2+SO2+2H2O=H2SO4+2HCl。


科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将0.2 molC(S)和0.3 mol H2O(g)投入2L的密闭容器中,发生反应C(S)+H2O(g)![]() CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
A. 从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 molL-1min-1
B. 达平衡时压强变为原来的7/6
C. 此温度下该反应的平衡常数为0.0125
D. 若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可进行二氧化硫的制备和某些性质的实验,请回答下列问题:

(1)A中盛放浓硫的仪器名称是______________。
(2)实验过程中,装置B试管内的___________现象证明SO2具有______性。
(3)实验过程中,装置C试管内的__________现象证明SO2具有______性,反应化学方程式为_____________。
(4)D的作用是_______。
(5)尾气可采用_____________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙分别是甲烷、苯中的一种,已知:乙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色;甲既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应,且一定条件下,1 mol甲可以和3 mol H2完全加成。
(1)甲的结构简式:___________,乙的空间结构:______________________;
(2)写出乙与Cl2反应生成一氯代物的化学方程式:__________________________________________;
(3)把甲加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在_________(填“上”或“下”)层;
(4)在浓硫酸作用下,甲与浓硝酸反应的化学方程式:_________________________________________;
(5)等物质的量的甲、乙完全燃烧消耗O2的物质的量________________(填“甲>乙”、“甲<乙”或“甲=乙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下图所示物质相互转换关系

试回答:
(1)写出B的化学式__________,D的化学式__________;
(2)写出由E转变成F的化学方程式__________;
(3)向G溶液中加入A的离子方程式__________;
向G溶液中加入铜片的离子方程式__________;
(4)简述B溶液中阳离子的检验方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将质量m g的有机物在氧气中完全燃烧,燃烧后全部产物缓慢通过足量过氧化钠,充分反
应后过氧化钠固体增重n g,关于下列情况说法正确的是
有机物 | n | |
A | CH4 | 2m |
B | HCHO | 3m/2 |
C | CH3OH和CH3COOH的混合物 | 2m/3 |
D | C2H5OH和CH3COOC2H5的混合物 | m |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅单质及其化合物在新能源领域应用广泛,工业上利用方铅精矿(主要成分为PbS)制备PbSO4的工艺流程如下:
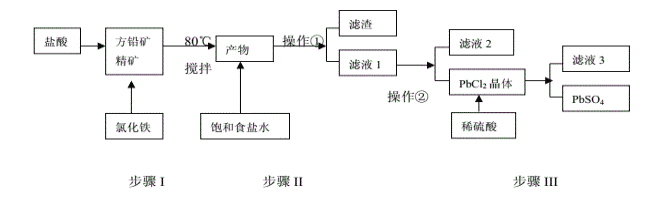
已知:①PbCl2(s)+2Cl-(aq)![]() PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
(1)步骤Ⅰ中发现有淡黄色沉淀生成,请写出离子反应方程式:_______________________;
(2)步骤Ⅰ原料预处理过程中写出一种除搅拌外加快反应速率的办法:_________________;反应温度不宜过高,且需加入过量盐酸保证溶液呈强酸性,原因是:____________________;
(3)操作①应为:_______ ;操作②应为:_________ ;
A、趁热过滤 B、蒸发浓缩,冷却结晶; C、蒸发结晶 D、重结晶
(4)写出步骤III中PbCl2生成PbSO4的离子反应方程式:___________________________ ,该反应的平衡常数K=_______;
(5)铅蓄电池(Pb-PbO2-H2SO4)充电时的阳极反应方程式:_________________________ ;
(6)某铅蓄电池放电时电流为0.2A,可持续放电时间96500s,此时参加反应的Pb的质量为41.4g,求该电池放电的能量转化率α=_________ 。(电池能量转化率的定义:α=实际输出电量/理论输出电量×100%,结果保留两位有效数字,已知法拉第常数为96500C/mol)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com