
| A. | 淀粉和纤维素在一定条件下水解均可得到葡萄糖 | |
| B. | 煤的干馏属于物理变化 | |
| C. | 油脂在酸性或碱性条件下的水解反应叫做皂化反应 | |
| D. | 石油分馏得到的各馏分都是纯净物 |
分析 A、淀粉和纤维素均为葡萄糖的脱水缩合物;
B、煤的干馏是将煤隔绝空气加强热使煤分解的过程;
C、油脂在碱性条件下水解出硬质酸钠;
D、石油的各种馏分仍然是混合物.
解答 解:A、淀粉和纤维素均为葡萄糖的脱水缩合物,故淀粉和纤维素水解后均得葡萄糖,故A正确;
B、煤的干馏是将煤隔绝空气加强热使煤分解的过程,是化学变化,故B错误;
C、肥皂的主要成分是硬质酸钠,而油脂只有在碱性条件下水解才能水解出硬质酸钠,在酸性条件下水解出硬脂酸,故油脂在碱性条件下的水解才称为皂化反应,故C错误;
D、石油的各种馏分仍然是多种烷烃和环烷烃的混合物,无固定熔沸点,故D错误.
故选A.
点评 本题考查了化学在生产和生活中的应用,难度不大,应注意的是煤的干馏是化学变化,而石油的分馏是物理变化.


科目:高中化学 来源: 题型:选择题
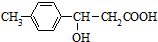 ,它可发生的有机反应的正确组合是( )
,它可发生的有机反应的正确组合是( )| A. | ①②③⑤⑥ | B. | ②③④⑥⑧ | C. | ①②③⑤⑥⑦ | D. | ④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 有机物 | 试剂 | 现象 |
| (1)乙烯 | ||
| (2)葡萄糖 | ||
| (3)淀粉 | ||
| (4)蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是一种黄绿色、密度比空气大的有毒气体 | |
| B. | 红热的铁丝在Cl2中剧烈燃烧,产生白色烟雾 | |
| C. | 工业上用Cl2和石灰乳为原料制造漂白粉 | |
| D. | Cl2能与水反应生成盐酸和次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| W | Z |
| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 原子半径大小:Y<W | |
| C. | 工业上用电解熔融的W与Z所形成的化合物来制取W | |
| D. | W和Y形成的化合物可与Z的氢化物的水溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl SiO2 CO2 | B. | NaCl CO2 SiO2 | ||
| C. | CO2 NaCl SiO2 | D. | SiO2 NaCl CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2完全转化为NH3 | |
| B. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| C. | 单位时间内消耗a mol N2同时消耗2amol NH3,说明该反应已达到平衡状态 | |
| D. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com