
| A. | 23g乙醇与足量的金属钠反应,可以放出0.25mol 氢气 | |
| B. | 1mol 乙醇充分燃烧生成2mol CO2 和3mol H2O,消耗3mol O2 | |
| C. | 乙醇的沸点高于乙烷 | |
| D. | 1mol 乙醇氧化后生成1mol 乙醛 |
分析 能说明乙醇的分子式是C2H6OH,说明其1个分子含有2个C原子、6个H原子和1个O原子即可,不能根据物理性质判断,以此解答.
解答 解:A.23g乙醇(即0.5mol)与足量钠反应只产生0.25mol氢气,则1mol乙醇能够与足量钠反应生成0.5mol氢气,说明1个乙醇分子中含有1个羟基,从而证明乙醇分子结构简式为C2H5OH,而不是CH3OCH3,故A错误;
B.1mol乙醇充分燃烧生成2mol CO2和3mol H2O,消耗3mol O2,依据元素守恒,说明1个乙醇分子中含有2个C原子、6个H原子和一个O原子,故B正确;
C.乙醇分子构成与沸点无关,故C错误;
D.1mol乙醇氧化后生成1mol乙醛与分子构成无关,故D错误;
故选B.
点评 本题考查了确定有机物结构简式的方法,题目难度不大,注意掌握常见有机物结构与性质,明确确定有机物分子式、结构式的方法.


科目:高中化学 来源: 题型:解答题
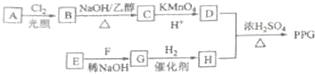
 .
. .
. ;
; (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
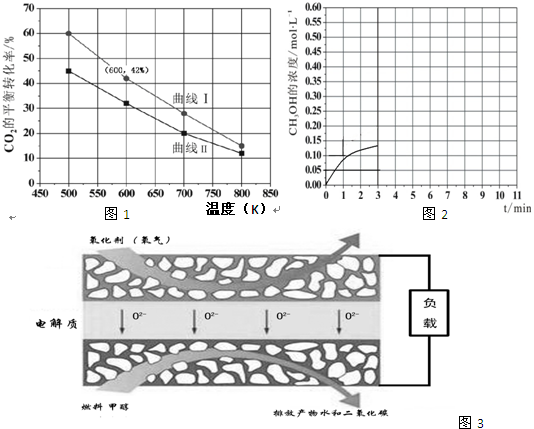
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
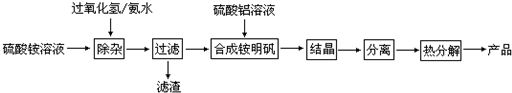
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
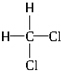 和
和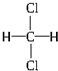 ③35Cl和37Cl
③35Cl和37Cl 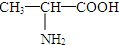 和 CH3-CH2-CH2-NO2 ⑤⑥(CH3)2CHCH(CH3)2和 (CH3)2CH(CH2)2CH3
和 CH3-CH2-CH2-NO2 ⑤⑥(CH3)2CHCH(CH3)2和 (CH3)2CH(CH2)2CH3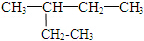 和
和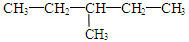
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维是一种能高质量传导光的玻璃纤维 | |
| B. | 光导纤维的抗干扰性能好,不发生电辐射,通讯质量高,能防窃听 | |
| C. | 高温结构陶瓷弥补了金属材料的弱点,但是硬度却远远低于金属材料 | |
| D. | 氮化硅陶瓷是一种重要的结构材料,具有超硬性,它能与氢氟酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| B. | 常温常压下,2.3gNa+中含有的电子数为NA | |
| C. | 标准状况下,11.2L臭氧含有的氧原子数为NA | |
| D. | 0.1 mol•L-1Na2CO3溶液中含有的钠离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 判断H2O2分解速率的大小,可以通过测定单位时间内H2O2分解放出的O2的体积 | |
| B. | 制摩尔盐时用酒精洗涤产品 | |
| C. | 用米汤直接检验食用盐中是否含有碘元素 | |
| D. | 以硝酸钠和氯化钾为原料可以制备硝酸钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com