
【题目】下列四个能级中,能量最高,电子最后填充的是( )
A.3sB.3pC.3dD.4s
科目:高中化学 来源: 题型:
【题目】顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下: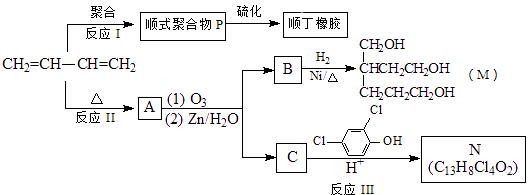
已知:i. 
ⅱ.RCH=CHR′ ![]() RCHO+R′CHO (R、R′代表烃基或氢)
RCHO+R′CHO (R、R′代表烃基或氢)
(1)CH2=CH﹣CH=CH2的名称是 .
(2)反应Ⅰ的反应类型是(选填字母) .
a、加聚反应 b、缩聚反应
(3)顺式聚合物P的结构式是(选填字母) . 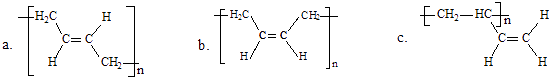
(4)A的相对分子质量为108.
①反应Ⅱ的化学方程式是 .
②1mol B完全转化成M所消耗H2的质量是g.
(5)反应Ⅲ的化学方程式是 .
(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在自然界中氢有三种同位素1H、2H、3H,氧也有三种同位素16O、17O、18O,若由上述元素的原子形成水分子,其中水分子的相对分子质量最大值是( )
A.18B.20C.22D.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO47H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)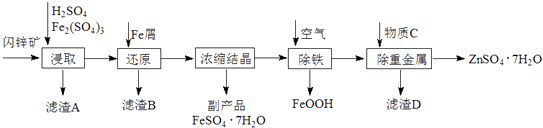
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 .
(2)浸取过程中Fe2(SO4)3的作用是 , 浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 .
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 . 该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 .
(4)置换法除重金属离子是Cd2+ , 所用物质C为 .
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、、过滤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下: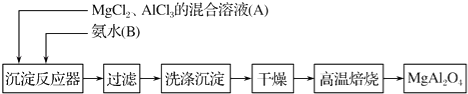
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为 .
(2)判断流程中沉淀是否洗净所用的试剂是 .
(3)在25℃下,向浓度均为0.01mol/L的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式: .
【已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Al(OH)3]=3×10﹣34】
(4)将Mg、Al组成的9.9g混合物投入一定量稀硝酸中,恰好完全反应,共收集到还原产物NO气体6.72L(标准状况),向反应后的溶液中加入4mol/L的Na0H溶液300mL时,则形成沉淀的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Clˉ,则SO42ˉ为( )
A.0.1mol/L
B.0.2mol/L
C.0.3mol/L
D.0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“固体干冰→液体二氧化碳→气体二氧化碳→气体一氧化碳”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力
B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用。某博物馆修复出土铁器的过程如下。
(1)检测锈蚀产物
主要成分的化学式 | |||
Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
铁器在具有O2、________等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ. Fe转化为Fe2+ 。
Ⅱ. Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为_______。
Ⅲ. FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ. Fe3O4保护层被氧化为FeO(OH),如此往复腐蚀。
![]() (将反应补充完整)___________
(将反应补充完整)___________
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5 mol/L Na2SO3、0.5 mol/L NaOH溶液的容器中,缓慢加热至60~90℃。一段时间,取出器物,用NaOH溶液洗涤至无Cl-。
① 检测洗涤液中Cl-的方法是________。
② 脱氯反应:FeOCl + OH-=FeO(OH) + Cl-。离子反应的本质是离子浓度的减小,比较FeOCl 与FeO(OH)溶解度的大小:________。
③ Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com