
下图是实验室制SO2并验证SO2某些性质的装置 图。请填写下列空白:

⑴⑥中发生化学反应方程式为______________________________。
⑵①中的实验现象为 ,
②中的品红溶液 (填实验现象),证明SO2有 性。
⑶③中的实验现象是 ,证明SO2有_______性,
发生化学反应方程式为____________________________________。
④中的实验证明SO2有 性,
发生化学反应方程式为____________________________________。.
⑷⑤中发生化学反应方程式为____________________________________。
科目:高中化学 来源: 题型:
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。
则S(s)+3F2(g)=SF6(g)的反应热△H为 ( )
A.-1780kJ/mol B.-1220 kJ/mol C.-450 kJ/mol D.+430 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.丙炔分子中三个碳原子位于同一直线上 B.丙烯与HCl加成只生成一种产物
C.1 mol丙烷在光照情况下,最多消耗4 mol氯气 D.丙烷中混有丙烯可用H2加热方法除去
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是
A.NaOH溶液 B.浓H2SO4
C.Ca(OH)2溶液 D.食盐水
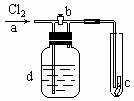
查看答案和解析>>
科目:高中化学 来源: 题型:
将氯气通入一定温度的氢氧化钾溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的溶液.测得该溶液中c(ClO-):c(ClO3-)= 2:1,则溶液中KCl和KClO的物质的量之比为 ( )
A. 1:1 B. 2:5 C. 7:2 D. 5:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验目的可以达到的是
A.准确称取0.40g的NaOH固体配成1000mL浓度为0.01000mol·L-1的NaOH溶液
B.将铜与足量的浓硝酸反应生成的气体干燥后收集,用冰水混合物冷却降温,以此研究温度对化学平衡的影响
C.将滴有稀硫酸的淀粉溶液加热后,加入新制的Cu(OH)2悬浊液,加热,没有红色沉淀,说明淀粉在该条件下没有水解。
D. 过滤时用玻璃棒搅拌漏斗中的液体,以加快过滤速度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述正确的是
A.滴定管洗净后,直接注入标准液进行滴定
B.某溶液先加入稀盐酸无明显现象,再加入BaCl2溶液产生白色沉淀,说明原溶液中含有SO42-
C.配制一定物质的量浓度的稀硫酸时,向容量瓶中加入适量的水,再缓缓注入事先量取的浓硫酸
D.某气体能使湿润的蓝色石蕊试纸变为红色,则该气体为氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是
A.氯化铝溶液中加入过量氨水反应实质是:
B.在加入铝粉能放出氢气的溶液中: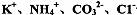 一定能够大量共存
一定能够大量共存
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,有一种叫Thibacillus Ferroxidans 的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐,发生的反应为:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中的Fe的化合价为+2,则被氧化的元素为
(2)工业上生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
 |
①分析下列表格(其中Ksp是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
步骤一应调节溶液的pH范围是 ,请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因
 ②步骤三中的具体操作方法是
②步骤三中的具体操作方法是
(3)有人提出可以利用如图的装置从溶液B中提炼金属铜。该过程中右边电极的反应式是 ,若装入B溶液500mL(电解前后溶液体积变化可忽略),当阴极增重1.6g时,停止通电,则反应后溶液的pH= 。
(4)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) ΔH
已知:①2Cu(s)+1/2O2(g)=Cu2O(s) ΔH=-12kJ/mol
②2Cu(s)+S(s)=Cu2S(s) ΔH=-79.5kJ/mol
③S(s)+O2(g)=SO2(g) ΔH=-296.8kJ/mol
则该法冶炼铜的反应中ΔH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com