
A、氨气分子的比例模型 |
| B、二氧化硅分子式为 SiO2 |
| C、乙烯的分子式为C2H4 |
| D、质量数为37的氯原子为1737Cl |
 为氨气的球棍模型,比例模型主要体现出各原子的相对体积大小;
为氨气的球棍模型,比例模型主要体现出各原子的相对体积大小; ,故A错误;
,故A错误;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、1mol 甲基所含电子数为10NA |
| B、0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA |
| C、在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA |
| D、标准状况下,2.24L 辛烷完全燃烧,生成CO2分子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:


 (R可表示烃基或氢原子)
(R可表示烃基或氢原子) 的合理线路(其他无机试剂任选,用流程图表示:写出反应物、产物及主要反应条件).
的合理线路(其他无机试剂任选,用流程图表示:写出反应物、产物及主要反应条件).| Cl2 |
| 光照 |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅠA族元素的金属性比第ⅡA族元素的金属性强 |
| B、同周期非金属氧化物对应水化物的酸性从左到右依次增强 |
| C、第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
| D、第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、H2、NH3的物质的量浓度不再改变 |
| B、nN2:nH2:nNH3=1:3:2 |
| C、N2和H2物质的量之和为NH3的2倍 |
| D、单位时间内反应1mol N2同时反应3mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
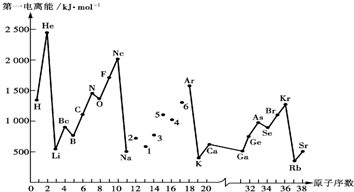
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com