
【题目】下列分子中,属于含极性键的非极性分子的是
A. CH4 B. H2S C. C60 D. HCl
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,缩小体积,平衡右移,SO2浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在一密闭容器中充入2mol A和3mol B,发生如下化学反应:aA+B![]() C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
A.60% B.40% C.50% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) ![]() Ca(OH)2(aq)
Ca(OH)2(aq) ![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
A、n (Ca2+)增大 B、c(Ca2+)不变
C、c(OH-)增大 D、n(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用一固体废渣(主要成份为Al2O3·Cr2O3,还含有FeO、SiO2)为主要原料回收利用,生产红矾钠晶体(Na2Cr2O7·2H2O),同时制备明矾(KAl(SO4)2·12H2O)。其主要工艺流程如下:

己知:NaBiO3不溶于冷水,在碱性条件下能将Cr3+氧化为CrO42-
(1)I、II 目的是___________。
(2)实验室中操作④的名称为 _______________。
(3)己知:Ksp[Fe(OH)3]=3.0×10-39,Ksp[Al(OH)3] = 3×10-33。当 pH =5.6 时 Cr(OH)3开始沉淀。室温下,II中需调节溶液pH范围为___________ (杂质离子浓度小于1×10-6mol/L视为沉淀完全)。
(4)写出Ⅲ中发生反应的离子方程式_____________。
(5)IV中酸化是用硫酸而不用盐酸酸化,理由是_____________ (结合化学方程式回答)。
(6)写出溶液F和硫酸溶液反应的离子方程式 _________,若用足量二氧化碳通入F中,则生成的溶液中离子浓度关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把过量铁屑加入氯化铁和氯化铜的混合溶液中,反应结束后,称得固体质量与所加铁屑的质量相等,则原溶液中( )
A. 7:2 B. 3:2 C. 2:3 D. 2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:
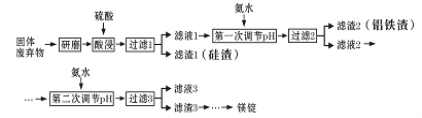
(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com