
| 元素代号 | K | L | M | Q | R | T | V | X |
| 原子半 径/nm | 0.183 | 0.102 | 0.152 | 0.099 | 0.077 | |||
| 主要化 合价 | +6 -2 | +1 | +7 -1 | |||||
| 其他 | 焰色反应呈黄色 | 阳离子核外无电子 | 最高价氧化物的水化物具有两性 | 最外层电子数是次外层的3倍 | 同周期中非金属性最强 | 最高正价和最低负价之和为0 |
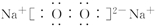 ,故答案为:
,故答案为: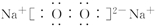 ;
; ,故答案为:
,故答案为: ;
;
| ||
| ||
| 15.6g |
| 78g/mol |
| 0.6mol |
| 0.5L |
| 1.2mol+0.2mol |
| 0.5L |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
 如图是SO2与O2在接触室中多段催化氧化2SO2(g)+O2(g)?2SO3(g)+Q(Q>0)回答下列问题:
如图是SO2与O2在接触室中多段催化氧化2SO2(g)+O2(g)?2SO3(g)+Q(Q>0)回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
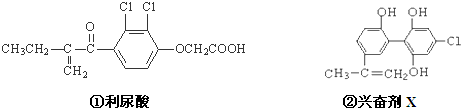
| A、利尿酸乙酯分子中有三种含氧官能团,在核磁共振氢谱上共有七个峰 |
| B、1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 |
| C、两种兴奋剂最多都能和含3molNaOH的溶液反应 |
| D、两种分子中的所有碳原子均不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大压强,化学反应速率一定增大 |
| B、化学反应速率为反应时间内反应物浓度的增加或者生成物浓度的减少 |
| C、升高温度,化学反应速率一定增大 |
| D、加入反应物,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2KClO3
| ||||
B、2P+5Cl2
| ||||
C、MnO2+4HCl(浓)
| ||||
D、H2+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤燃烧主要是化学能转化为光能的过程 |
| B、人类使用照明设备主要是将电能转化为光能 |
| C、动物体内葡萄糖被氧化成CO2是化学能转变成热能的过程 |
| D、化石燃料燃烧时放出的能量均于太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氯乙烷中直接加入AgNO3溶液 |
| B、在氯乙烷中加蒸馏水,然后加入AgNO3溶液 |
| C、在氯乙烷中加入NaOH溶液,加热,冷却后酸化,然后加入AgNO3溶液 |
| D、在氯乙烷中加入乙醇,加热,冷却后酸化,然后加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3Cl+Cl2→CH2Cl2+HCl | |||
| B、CH2=CH2+HO-H→HOCH2-CH3 | |||
C、CH3COOCH2CH3+H2O
| |||
D、 +Br2 +Br2
 +HBr +HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com