
| A.①②③④⑤⑥ | B.①②③④⑤ | C.①②③④ | D.①②③ |
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子间形成的氢键使物质的熔点和沸点升高; |
| B.冰中存在氢键,水中不存在氢键; |
| C.每一个水分子内含有两个氢键; |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.HI的相对分子质量大于HF,所以HI的沸点高于HF |
| D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| B.P4和CH4都是正四面体分子且键角都为109o28ˊ |
| C.CsCl晶体中与每个Cs+距离相等且最近的Cl-共有8个 |
| D.原子晶体的熔沸点一定比金属晶体的高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
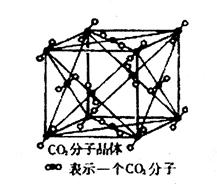
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 :
: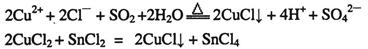
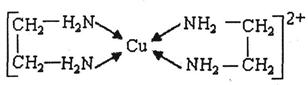
 。
。 中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。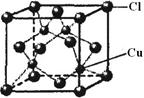
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com