
| 化合物/选项 | A | B | C | D |
| Y | H2O | Fe2O3 | C2H5OH | FeCl3 |
| W | Fe3O4 | Al2O3 | C2H5ONa | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 ①铁和水蒸气在高温条件下生成Fe3O4和氢气,属于置换反应;
②氧化铁和金属铝反应生成氧化铝和铁,发生铝热反应,属于置换反应;
③乙醇和金属钠反应生成乙醇钠和氢气,符合置换反应概念;
④氯化铁和铜反应生成氯化铜和氯化亚铁,不属于置换反应.
解答 解:①铁和水蒸气在高温条件下生成Fe3O4和氢气:3Fe+4H2O=Fe3O4+4H2,属于置换反应;故①不符合;
②氧化铁和金属铝反应生成氧化铝和铁,发生铝热反应,2Al+Fe2O3=2Fe+Al2O3,属于置换反应;故②不符合;
③乙醇和金属钠反应生成乙醇钠和氢气,2Na+2CH3CH2OH=2CH3CH2ONa+H2↑符合置换反应概念;故③不符合;
④氯化铁和铜反应生成氯化铜和氯化亚铁,不属于置换反应;
综上所述:④符合;
故选D.
点评 本题考查了置换反应的分析判断,物质性质的掌握是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题


 .
.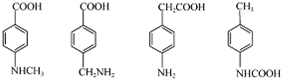 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A. | W点所示的溶液中:c (Na+)+c (H+)=2c (CO32-)+c (OH-)+c (Cl-) | |
| B. | pH=4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol•L-1 | |
| C. | pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)=c (OH-)+c (Cl- ) | |
| D. | pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32-)>c (HCO3-)>c (H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2p轨道上有3个不成对电子的元素 | |
| B. | 最外层电子数是次外层电子数的3倍的元素 | |
| C. | 形成化合物种类最多的元素 | |
| D. | 周期数等于族序数等于次外层电子数的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8mL | B. | 9mL | C. | 10mL | D. | 12mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com