
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.80 | 20.01 | 20.00 | 19.99 |
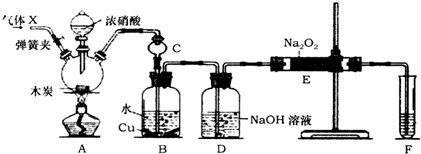
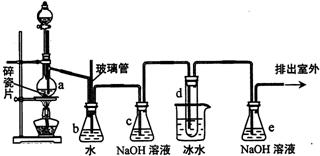
分析 A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水,通过装置D中氢氧化钠溶液吸收二氧化碳,通过装置E中的过氧化钠吸收一氧化氮,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
(1)一氧化氮容易与空气中的氧气反应生成二氧化氮;
(2)长颈漏斗上方面积大可防止倒吸;二氧化氮恒容水反应生成硝酸和一氧化氮,硝酸能和铜反应,据此分析反应现象;
(3)分析可知装置D中出来的一氧化氮气体会含有水蒸气,进入装置E会和过氧化钠反应生成氢氧化钠,E装置前后都需要连接气体进干燥装置;
(4)检验E中白色固体中含NO2-,可以利用反应3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O,生成的一氧化氮遇到氧气生成红棕色气体二氧化氮;
(5)a.酸式滴定管用蒸馏水洗净后未用标准液润洗,酸性高锰酸钾溶液浓度变稀;
b.锥形瓶水洗净后待测液洗涤,溶质的物质的量变大;
c.滴定终点时俯视读数,读数在液面上方,滴定管刻度由上而下增大;
d.滴定结束后滴定管尖嘴处仍悬有液滴,高锰酸钾溶液体积读数应大于实际消耗量;
第1组实验数据偏大,第2、3、4组数据平均值为消耗高锰酸钾溶液体积,2MnO4-~5NO2-,根据方程式计算产品中亚硝酸钠的质量分数.
解答 解:(1)A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,为防止装置中空气中的氧气氧化生成的一氧化氮,应先通入氮气排尽装置内的空气,
故答案为:N2;排尽系统内空气,以免生成的一氧化氮被空气中的氧气氧化;
(2)NO2极易溶于水与水反应,所以装置C的作用是防止倒吸,B中二氧化氮和水反应生成硝酸,3NO2+H2O=2H++2NO3-+NO,硝酸和铜反应生成硝酸铜、一氧化氮和水,3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,观察到的现象为:铜片减小、溶液变蓝色、有气泡冒出,
故答案为:防止B中溶液倒吸;铜片减小、溶液变蓝色、有气泡冒出;
(3)生成的NO中含有CO2和水蒸气,通过氢氧化钠溶液吸收二氧化碳,含有的水蒸气能与过氧化钠反应,则E中产物除亚硝酸钠外还含有副产物NaOH,碱石灰可以吸收水蒸气,可以在装置DE之间和EF装置之间添加干燥装置,
故答案为:NaOH;装置DE之间和装置EF之间添加干燥装置;
(4)检验E中白色固体中含NO2-,可以利用反应3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O,生成的一氧化氮遇到氧气生成红棕色气体二氧化氮,实验设计为:取少量E中白色固体加入稀盐酸产生无色气体,遇到空气变化为红棕色证明固体中含有亚硝酸根离子,
故答案为:取少量E中白色固体加入稀盐酸产生无色气体,遇到空气变化为红棕色证明固体中含有亚硝酸根离子;
(5)a.酸式滴定管用蒸馏水洗净后未用标准液润洗,酸性高锰酸钾溶液浓度变稀,消耗体积应偏大,故a符合;
b.锥形瓶用水洗净后又用待测液润洗,消耗高锰酸钾溶液体积偏大,故b符合;
c.滴定终点时俯视读数,读数在液面上方,滴定管刻度由上而下增大,则读数偏小,故c符合;
d.滴定前尖嘴有气泡,滴定后气泡消失,消耗高锰酸钾溶液体积读数应大于实际消耗量,故d符合,
故选abd,
第1组实验数据偏大,消耗高锰酸钾溶液体积为$\frac{(20.01+20.00+19.99)ml}{3}$=20mL,
设产品中亚硝酸钠的物质的量为n,则:
2MnO4-~~~5NO2-,
2 5
0.1mol/L×0.020L n
解得n=0.005mol,
500ml中含亚硝酸根离子物质的量=$\frac{500ml}{50ml}$×0.005mol=0.05mol,
产品中亚硝酸钠的质量分数=$\frac{0.05mol×69g/mol}{4.5g}$×100%=76.7%
故答案为:abd;76.7%.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,掌握物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,33.6L三氧化硫中含有硫原子的数目为1.5 NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度(g/mL) | 0.79 | 2.18 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
| 熔点/℃ | -114.3 | 9.79 | -116.2 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com