
【题目】高温条件下,Al和Fe3O4反应生成Fe和Al2O3。下列说法正确的是

A.该反应过程中的能量变化如图所示
B.该反应条件下,Al的还原性弱于Fe
C.实验室进行该反应时常加入KClO3作催化剂
D.1molFe3O4参与反应转移8×6.02×1023个电子
【答案】D
【解析】
A.铝热反应属于放热反应;
B.氧化还原反应中还原剂的还原性大于还原产物的还原性;
C.铝热反应中氯酸钾受热分解生成氧气;
D.反应中Fe元素的化合价从+8/3价降低到0价。
A. 铝热反应属于放热反应,反应物的总能量大于生成物的总能量,图象不符,故A错误;
B. Al和Fe2O3反应生成Fe和Al2O3,Al作还原剂,Fe是还原产物,所以Al的还原性强于Fe,故B错误;
C. 铝热反应中氯酸钾受热分解生成氧气,反应中KClO3不是催化剂,故C错误;
D. 反应中Fe元素的化合价从![]() 价降低到0价,所以1molFe3O4参与反应转移8×6.02×1023个电子,故D正确;
价降低到0价,所以1molFe3O4参与反应转移8×6.02×1023个电子,故D正确;
故答案选D。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】向 Fe 和 Fe2O3 组成的 3.84g 混合物中加入 120mL 某浓度的盐酸,恰好完全反应,生成 672mL H2(标准状况下);向反应后的溶液中滴加几滴 KSCN 溶液,溶液无明显变化。(结果保留三位有效数字)
(1)原混合物中Fe 的质量为____________g.
(2)所用盐酸的物质的量浓度为____________mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L- 1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示。

(1)原HA中水电离出的c(H+)=________mol·L-1
(2)与曲线I上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下、容积不变的密闭容器中,可逆反应 A(g)+3B(g)![]() 2C(g)+2D(s)达到平衡的标志的是( )
2C(g)+2D(s)达到平衡的标志的是( )
① C 的生成速率与 C 的消耗速率相等 ②单位时间内生成 amolA,同时生成 3amolB ③ A、B、C 的浓度不再改变 ④混合气体的密度不再改变 ⑤ 混合气体的总压强不再改变 ⑥混合气体的总物质的量不再改变⑦ A、B、C、D 浓度之比为 1:3:2:2
A.③④⑤⑥⑦B.①③④⑤⑥C.①②④⑦D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:键能指在标准状况下,将 1mol 气态分子 AB(g)解离为气态原子 A(g),B(g)所需的能量,用符号 E 表示,单位为 kJ/mol。N≡N的键能为 946 kJ/mol,H-H 的键能为 436 kJ/mol,N-H 的键能为 391 kJ/mol,则生成 2 mol NH3 过程中______(填“吸收”或“放出”)的能量为______。
II.(1)下列装置属于原电池的是 ______;
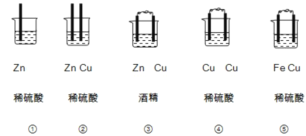
(2)在选出的原电池中,______是负极,发生______反应,正极的现象______;
(3)此原电池反应的化学方程式为______。
(4)将 CH4设计成燃料电池, 其利用率更高, 装置如图所示( A、B 为多孔碳棒), 电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O。
①实验测得 OH-定向移向 B 电极,则_______处电极入口通甲烷(填 A 或 B)。
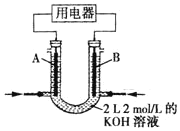
②当消耗甲烷的体积为 33.6L(标准状况下)时,假设电池的能量转化率为 80%,则导线中转移电子的物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下pH为2的盐酸与等体积pH=12的氨水混合后所得溶液显酸性
B. 中和等体积、等物质的量的浓度的盐酸和醋酸,盐酸消耗的n(NaOH)大
C. 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
D. CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-akJ·mol一1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-bkJ·mol一1
③CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-ckJ·mol一1
则下列叙述正确的是( )
A. 由上述热化学方程式可知b>c
B. 甲烷的燃烧热为bkJ/mol
C. 2CH3OH(g)=2CH4(g) +O2(g) △H=2(b一a)KJ mol一1
D. 当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 对于2NO2(g)![]() N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,混合气体的颜色变浅
N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,混合气体的颜色变浅
B. 化学平衡正向移动,反应物的转化率一定增大
C. 往平衡体系FeCl3+3KSCN![]() Fe(SCN)3+3KCl中加入适量KCl固体,平衡逆向移动,溶液的颜色变浅
Fe(SCN)3+3KCl中加入适量KCl固体,平衡逆向移动,溶液的颜色变浅
D. C(s)+CO2(g)![]() 2CO(g) ΔH>0,其他条件不变时,升高温度,反应速率v(CO2)和CO2的平衡转化率均增大
2CO(g) ΔH>0,其他条件不变时,升高温度,反应速率v(CO2)和CO2的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2A(g)+2B(g)![]() C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
A. 移走少量C B. 扩大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入“惰”气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com