
(10分)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料, 防腐等工业。该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。已知pH为5时,+2价铜已开始以碱式盐的形式沉淀。某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:
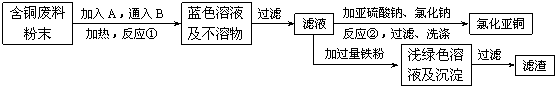

⑴ 加入的A是 ,通入的B是 。
 ⑵ 反应②的离子方程式是 。
⑵ 反应②的离子方程式是 。
为提高Cu2Cl2的产率,常在反应②的溶液中加入
适量稀碱溶液,控制pH为3.5。这样做的目
的是 。
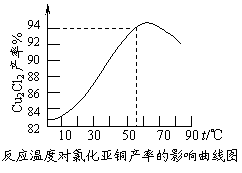
⑶ 保持各反应物的最佳配比,改变温度,测得
Cu2Cl2产率的变化如下图所示。则溶液温度控
制在 时,Cu2Cl2的产率已达到94%,
当温度高于65℃时,Cu2Cl2产率会下降,其原
因可能是 。
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:阅读理解
 氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程图.请回答以下问题:
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程图.请回答以下问题:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:2011届江苏省姜堰市二中高三上学期学情调查(三)化学试卷 题型:填空题
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料, 防腐等工业。该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。已知pH为5时,+2价铜已开始以碱式盐的形式沉淀。某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:

⑴ 加入的A是 ,通入的B是 。
⑵ 反应②的离子方程式是 。为提高Cu2Cl2的产率,常在反应②的溶液中加入适量稀碱溶液,控制pH为3.5。这样做的目的是 。
⑶ 保持各反应物的最佳配比,改变温度,测得Cu2Cl2产率的变化如下图所示。则溶液温度控制在 时,Cu2Cl2的产率已达到94%,当温度高于65℃时,Cu2Cl2产率会下降,其原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省姜堰市高三上学期学情调查(三)化学试卷 题型:填空题
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料, 防腐等工业。该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。已知pH为5时,+2价铜已开始以碱式盐的形式沉淀。某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:


⑴ 加入的A是 ,通入的B是 。
⑵ 反应②的离子方程式是 。为提高Cu2Cl2的产率,常在反应②的溶液中加入适量稀碱溶液,控制pH为3.5。这样做的目的是 。
⑶ 保持各反应物的最佳配比,改变温度,测得Cu2Cl2产率的变化如下图所示。则溶液温度控制在 时,Cu2Cl2的产率已达到94%,当温度高于65℃时,Cu2Cl2产率会下降,其原因可能是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com