
【题目】工业上利用电解饱和食盐水生产氯气、烧碱和氢气。
(1)该反应的化学方程式是:_______ 。
(2)电解食盐水的过程中,其中氧化剂为______,还原剂为_______。
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1:1,Y原子最外层s电子与p电子数之比为l:1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式_______。
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为_____<_____(用分子式表示)。_________
(3)这四种元素原子半径的大小为_______>_______>_______ >_______ (填元素符号)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:

(1)Co2+基态核外电子排布式为________。
(2)NH2OH分子中氮原子轨道的杂化类型是_______,lmolNH2OH分子中含有σ键的数目为_______。
(3)N、H、O三种元素的电负性由小到大的顺序为_________。
(4)ClO4-的空间构型为__________。
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1=-159.47kJ/mol K1
NH2COONH4(s) △H1=-159.47kJ/mol K1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3 K3
CO(NH2)2(s)+H2O(g) △H3 K3
请回答下列问题:
(1)①总反应的△H3=_______kJ/mol。该热化学方程式的平衡常数K3=____________(用K1、K2表示)。
②反应I一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列不能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2)
D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)。
(2)在体积可变的恒压(p总)密闭容器中充入1 mol CO2 与足量的碳,让其发生反应:C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。

①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“=”);若充入等体积的CO2 和CO,平衡________移动(填“正向”“逆向”或“不”)。
②650℃,CO2 的转化率为_____________。
③已知:气体分压(P分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡常数,925℃时,Kp=_____________ (用含P总的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.塑料、天然橡胶都是天然高分子化合物
B.乙烯、聚乙烯和苯分子中均含有碳碳双键
C.棉花、羊毛、涤纶的成分均属于天然纤维
D.天然橡胶的化学成分是聚异戊二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜混合粉末17.6 g加入到800mL 1.0mol/L的 FeCl3溶液中,充分反应后,所得溶液中Fe2+和Cu2+物质的量浓度之比为8∶1。下列有关说法正确的是
A. 混合粉末中铁与铜的物质的量之比是1∶2
B. 反应后的溶液最多还可以溶解铁粉5.6g
C. 反应后所得溶液中c(Fe2+)=1.0mol/L (假设反应前后溶液体积无变化)
D. 向反应后的溶液中加入2.0 mol/L NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是1.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常见的荧光棒的发光原理可用下式表示:
![]() +H2O2 → 2
+H2O2 → 2![]() + 2CO2
+ 2CO2
二苯基草酸酯
上述反应产生的能量传递给荧光染料分子后,染料分子释放荧光。下列说法不正确的是
A. 可用氯化铁溶液检验上述反应有苯酚生成
B. 荧光棒发光过程涉及化学能到光能的转化
C. 二苯基草酸酯苯环上的一氯代物共有3种
D. 二苯基草酸酯与草酸二甲酯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
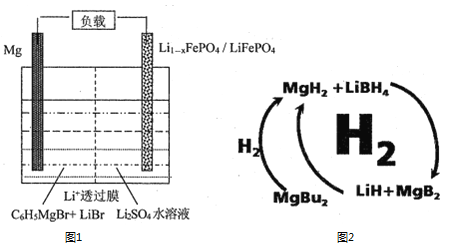
(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为_____(填“正极”或“负极”)。
②充电时,Li+迁移至_____________(填“阳极区”或“阴极区”)。
(2)纳米MgH2和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为_____________________________________________。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =____kJ·mol-1
(4)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
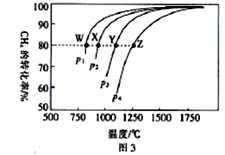
①图中p1、p2、p3、p4代表不同压强,压强最大的是_______。该反应的△H___(填“>”“<”“=”下同)0。
②压强为p4时,在Y点:v(正)__________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com