
【题目】下列描述中不正确的是( )
A.CS2为V形的极性分子
B.Cl ![]() 的空间构型为三角锥形
的空间构型为三角锥形
C.SF6中有6对完全相同的成键电子对
D.SiF4和S ![]() 的中心原子均为sp3杂化
的中心原子均为sp3杂化
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】对于苯乙烯( ![]() )的下列叙述中:①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯;⑤能发生硝化反应;⑥所有的原子可能共平面.其中正确的是( )
)的下列叙述中:①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯;⑤能发生硝化反应;⑥所有的原子可能共平面.其中正确的是( )
A.①②③④⑤
B.①②⑤⑥
C.①②④⑤⑥
D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.用惰性电极电解MgCl2溶液:2Cl﹣+2H2O ![]() ?Cl2↑+H2↑+2OH﹣
?Cl2↑+H2↑+2OH﹣
B.向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O
C.过氧化钠与水反应:2O22﹣+2H2O=4OH﹣+O2↑
D.一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH﹣+Al3++2SO42﹣=2BaSO4↓+AlO2﹣+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示: 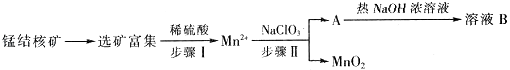
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1molL﹣1的NaClO3溶液200ml,该反应离子方程式为 .
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是 .
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 . 如果维持电流强度为5A,电池工作五分钟,理论消耗锌g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 . 向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2 , 铁溶解变为Fe3+ , 加碱调节pH为时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全).继续加碱调节pH为时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1).若上述过程不加H2O2 , 其后果和原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+206.1kJmol﹣1
②2H2(g)+CO(g)CH3OH(l)△H2=﹣128.3kJmol﹣1
③2H2(g)+O2(g)2H2O (g)△H3=﹣483.6kJmol﹣1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 .
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/molL﹣1 | H2O初始浓度/molL﹣1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 .
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为 .
②“热分解系统”中每分解l mol Fe xOy , 转移电子的物质的量为 . 
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10﹣3molL﹣1 , 则该溶液中溶质的pC=﹣lg(1×10﹣3)=3.如图2为25℃时H2CO3溶液的pC﹣pH图.请回答下列问题 (若离子浓度小于10﹣5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1= .
③人体血液里主要通过碳酸氢盐缓冲体系 ![]() 可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的 ![]() 最终将 .
最终将 .
A.变大B.变小C.基本不变D.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X,Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) 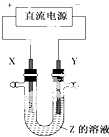
A.氯碱工业中,X,Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化. 
请回答下列问题:
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应,Ba(OH)28H2O与NH4Cl的反应是热反应.反应过程(填“①”或“②”)的能量变化可用图2表示.
(2)下列变化属于放热反应的是 A.碳酸钙的分解反应 B.酸碱中和反应 C.碳和水蒸气的反应 D.浓硫酸稀释 E.实验室制取氨气 F.实验室制取氢气
(3)现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2①以上两个反应能设计成原电池的是
②写出设计原电池正、负极电极反应式正极:负极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B. 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C. 两原子,如果核外电子排布相同,则一定属于同种元素
D. 只有在原子中,质子数才与核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间的反应没有明显反应现象的是( )
A. 将CO2通入硝酸钡中
B. 用玻璃棒分别蘸取浓盐酸和浓氨水并相互靠近
C. 硅酸钠溶液中通入二氧化碳
D. 将氯化氢气体通入滴有酚酞的烧碱溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com