
| A. | 升高温度,K减小 | B. | 减小压强,n(CO2)增加 | ||
| C. | 更换高效催化剂,α(CO)增大 | D. | 充入一定量的氮气,n(H2)不变 |
分析 A.升高温度,平衡向逆反应方向移动;
B.减小压强,平衡向体积增大的方向移动;
C.催化剂不会引起化学平衡的移动;
D.在一定温度和压强下,充入一定量的氮气,相当于混合气体压强减小,平衡向气体体积增大的方向移动.
解答 解:A.△H<0,正反应放热,升高温度平衡向逆反应方向移动,平衡常数减小,故A正确;
B.比较方程式气体的计量数关系,反应前气体的计量数等于反应后气体的计量数之和,则减小压强,平衡不移动,n(CO2)不变,故B错误;
C.催化剂能改变反应速率,但不会引起化学平衡的移动,所以α(CO)不变,故C错误;
D.充入一定量的氮气,相当于混合气体压强减小,平衡向气体体积增大的方向移动,但该反应前后气体体积不变,平衡不移动,n(H2)不变,故D正确;
故选AD.
点评 本题考查化学平衡的影响因素,题目难度不大,本题注意观察方程式的特征,把握外界条件对平衡状态的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
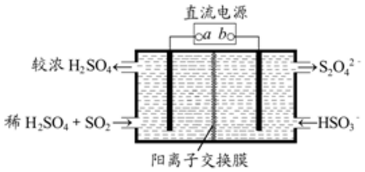 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )| A. | a为直流电源的负极 | |
| B. | 与 b电极相连的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O | |
| C. | 与 a相连的电极发生还原反应得到SO42- | |
| D. | 电解时,H+由阴极室通过阳离子交换膜到阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛.
氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 小苏打用作焙制糕点的膨松剂 | Na2CO3溶液呈碱性 |
| B | 明矾可用于净水 | 明矾在水中生成的氢氧化铝胶体有吸附性 |
| C | SiO2用于制造光导纤维 | SiO2有导电性 |
| D | SO2可使溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7 | |
| B. | 钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 | |
| C. | 高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性 | |
| D. | 邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应aA(s)+bB(g)?cC(g)+dD(g)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示(填“增大”“减小”“吸”“放”“正”“逆”)
反应aA(s)+bB(g)?cC(g)+dD(g)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示(填“增大”“减小”“吸”“放”“正”“逆”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧时加入少量生石灰的目的是减少废气中的二氧化碳排放 | |
| B. | 空气中PM2.5(2.5微米以下的颗粒物)的存在可能形成丁达尔效应 | |
| C. | 葡萄糖、蔗糖、油脂和蛋白质等营养物质在人体吸收后都能被水解 | |
| D. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮、氧化变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com