
(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图晶体结构。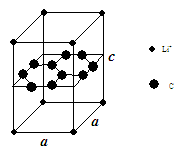
化学式为 ,该电池负极放电方程式为 。
Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
Li+与相邻石墨六元环作用力属何种键型? 。
(2)石墨中键角为 ,C原子杂化方式为 ;实验测得石墨、苯和乙烯分子中C-C键键长依次为142、140、133 pm。请对上述系列中键长依次递减的现象作出合理的解释 。
(3)第ⅡA金属碳酸盐分解温度如下:
| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
(1) LiC6(2分) LiC6 =Li+ + 6C + e-(2分) (2分) 离子键(1分)
(2分) 离子键(1分)
(2)120º (1分) sp2(1分)
石墨中一个C-C键平均有0.67个π电子;苯中一个C-C键平均有1个π电子;乙烯中一个C-C键平均有2个π电子;由于π电子从0.67、1增加到2,所以键长缩。(2分)
(3)BeCO3 =" BeO" + CO2↑ (2分)
阳离子半径越小对氧的吸引力越大,夺取氧的能力越强。(2分)
解析试题分析:
(1)图中晶胞中,Li+离子在8个顶角上,平均为1个,C原子有8个在面上,平均为4,心里有2个,共6个碳原子,故化学式为LiC6,从投影来看,Li+最近的2个Li+都是沿着正六边形的一条边过去的,很容易找到其他6个投影的Li+。
(2)石墨中每个碳原子与其它3个碳原子相连,构成平面结构,故键角为120º,每个碳原子都是sp2(1分);
石墨中一个C-C键平均有0.67个π电子;苯中一个C-C键平均有1个π电子;乙烯中一个C-C键平均有2个π电子;由于π电子从0.67、1增加到2,所以键长缩。(2分)
由表中数据可知在碳酸盐中金属阴离子的半径越小,对氧原子的吸引力越大,夺取氧离子的能力越强。
考点:物质结构与性质。
考点:官能团为酯键的芳香化合物的性质。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题
(11分)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的
形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)Ⅰ(1)过渡金属元素有很多不同于主族元素的性质,如能形成多种配合物,如:Fe(CO)x、[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]、[Cu(NH3)4]SO4等。
①Cu位于元素周期表第四周期第 族。
②配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。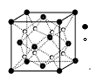
Ⅱ(3)液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
①写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
②下列能说明碳与硫两元素非金属性相对强弱的是 。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
③羰基硫在水存在时会缓慢水解生成H2S,使溶液的pH约为6.5左右,此时钢铁设备会产生的电化学腐蚀主要是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语
回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为_______(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_______>_______。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe+氧化,写出该反应的离子方程式_______。
(4)由表中元素形成的物质可发生如图中的反应,
其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式______________.
②写出检验A溶液中溶质的阴离子的方法:______________.
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为_______mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学–选修3:物质结构与性质】(15分)
X、Y、Z、W四种元素原子序数依次增大且均小于36。 Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒, W基态原子有10个价电子。回答下列问题(以下问题均以推知元素符号作答):
(1)若 YX3与X2Z﹑YX2-与ZX-﹑Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式
⑵已知0℃时X2Z的密度为a g/cm3,其晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因是 。两个X2Z分子间的最近距离为 pm(用a和NA表示)。 已知X2Y的升华热是51 kJ/mol,除氢键外,X2Z分子间还存在范德华力(11 kJ/mol),则X2Z晶体中氢键的“键能”是 kJ/mol。
⑶ WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)2·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为 ,其核外电子有 种运动状态。
②尿素分子中碳原子的杂化方式为 ,1 mol尿素分子中含有的σ键数为 。
③YZ3-的空间构型 。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6∶91。若该晶体的化学式为WxZ,则x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的化学键的类型为 。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)下表中列出五种短周期元素X、Y、Z、W、T的信息。
| 元素 | 相关信息 |
| X | 基态原子最外层电子排布为nsnnpn+1 |
| Y | 其原子L层电子数是K层3倍 |
| Z | 其单质能与冷水剧烈反应,生成的阴阳离子电子数相同 |
| W | 其单质在Y2中燃烧,发出明亮的蓝紫色火焰 |
| T | 其最高正价与最低负价的代数和为6 |
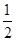 Y2(s)=Z2Y(s) △H1=-414KJ/mol
Y2(s)=Z2Y(s) △H1=-414KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: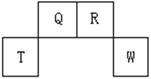
(1)W在周期表中的位置是 , Q、R、T三种元素原子的半径从大到小排列顺序 (用元素符号表示),Q的最高价氧化物的电子式 ,R气态氢化物分子的结构式为 ;
(2)元素的原子得电子能力:Q W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点 (填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是 (填名称);
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在下表中的对应编号 ,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号 。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.6 | 0.75 | 0.82 |
| 最高或最低化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
| -2 | | | -3 | -1 | | -3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)32Ge原子核外电子有 种不同的运动状态,原子核外电子排布式为 。
(2)写出氮原子的核外电子的轨道表示式 。
(3)写出CCl4的电子式 ,其中心原子的杂化方式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com