
| A.热稳定性:H2O>NH3>PH3 | B.原子半径:Si>Na>O |
| C.碱性:CsOH>KOH>NaOH | D.失电子能力:K>Na>Mg |
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.第三周期ⅣA族 | B.第三周期ⅢA族 |
| C.第四周期ⅣA族 | D.第四周期ⅣB族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.仅③ | B.①③ | C.②④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
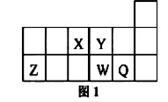
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.Z的氧化物能与水反应 |
| C.离子Y2-和Z 3+的核外电子数和电子层数都相同 |
| D.元素Y的氢化物的稳定性比W的氢化物强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 甲 | |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钚—239的质子数为239 | B.氢氧化铯的碱性比氢氧化钾强 |
| C.碘元素的相对原子质量为131 | D.硼酸的酸性比铝酸(氢氧化铝)弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | | J | | |
| | | | | R |
| | I1 | I2 | I3 | I4 | …… |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 | …… |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com