
【题目】实现下列物质间的转化,需加入还原剂的是
A. SO2→SO3 B. Na2SO3→SO2 C. SO2→S D. H2S→S
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KHCO3溶液跟30.0g质量分数为24.0%的KHCO3溶液混合,得到密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数__________。
(2)混合后溶液的物质的量浓度________。
(3)在1000g水中需溶解___________摩尔KHCO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:

有关数据列表如下:

回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是
______________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入____,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是______________________;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”或“下”);
(5)连接有长玻璃导管的装置B的作用是__________________;
(6)若产物中有少量副产物乙醚,可用__________________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是__________________;但又不能过度冷却(如用冰水),其原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3与CH3CH2COOCH3为同一种物质
B.C70与14C互为同素异形体
C.乙醇易溶于水,丙三醇(甘油)难溶于水
D.2,2﹣二甲基丙烷的一氯代物只有一种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的叙述正确的是
A. 常温下,浓硝酸可以使金属镁钝化
B. 稀硝酸与活泼金属反应主要放出氢气
C. 浓硝酸和稀硝酸都是强氧化剂
D. 室温下,铜能与浓硝酸度应,不能与稀硝酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A. 常温常压下,11.2 LCO2所含的原子数为1.5NA
B. 常温常压下,48 g O3含有的氧原子数为3NA
C. 标准状况下,224 L H2中所含原子数为NA
D. 标准状况下,1 L水所含分子数为![]() NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在热的碱性溶液中,NaClO发生如下反应:3NaClO![]() 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A. NaCl、NaClO B. NaCl、NaClO3
C. NaClO、NaClO3 D. NaClO3、NaClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400 ℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内药品均足量,部分夹持装置已省略。)
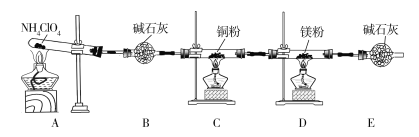
(1)在实验过程中发现C中铜粉由红色变为黑色,说明产物中有____________(填化学式)生成。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为______________。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是_________________________________。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:
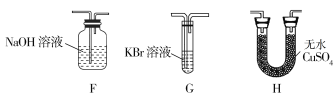
①按气流从左至右,装置的连接顺序为A→________→________→________。
②实验结束后发现G中液体变为橙黄色,用必要的文字和方程式解释出现该现象的原因:________________________。
③F中发生反应的离子方程式为___________________________。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为________________________________________________。
(6)在实验过程中仪器E中装有碱石灰的目的是________________;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__________(填“偏大”“偏小”或“无法判断”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com