
某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4。其工艺流程如下:
下列推断不合理的是 ( )。
| A.往甲中通CO2有利于(NH4)2SO4生成 |
| B.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| C.在实际生产中CO2可被循环使用 |
| D.直接蒸干滤液能得到纯净的(NH4)2SO4 |
科目:高中化学 来源: 题型:填空题
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下: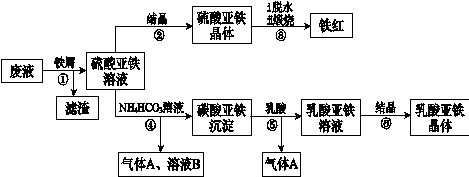
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、 。
(1)步骤④的离子方程式是 。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了3种燃煤烟气脱硫方法的原理。
| 方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
充分利用能源、提高原子利用率、减少向环境排放废弃物等都是绿色化学的基本要求。①在有机实验中,用溴的四氯化碳溶液代替溴的水溶液;②用稀硝酸代替浓硝酸溶解、回收银镜试管中的银;③用水浴加热代替直接用酒精灯加热;④接触法制硫酸中采用“热交换器”,利用余热预热冷原料气和烧水;⑤工业合成氨中分离产物得到氢气和氮气再循环使用;⑥电解法冶炼钠和镁,选择电解氯化钠和氯化镁,不电解对应的金属氧化物。上述主要不是从绿色化学角度考虑的是( )
| A.①③ | B.②④ | C.⑤⑥ | D.③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列说法正确的是( )。
2NH3(g) ΔH<0,下列说法正确的是( )。
| A.达到平衡时反应物和生成物浓度一定相等 |
| B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大 |
| C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动 |
| D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( )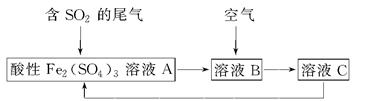
| A.溶液B中发生的反应为2SO2+O2=2SO3 |
| B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ |
| C.由以上流程可推知氧化性:Fe3+>O2>SO42— |
| D.此工艺的优点之一是物质能循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关接触法制硫酸的叙述不正确的是( )。
| A.硫磺和硫铁矿均可作为生产原料 |
| B.将矿石粉碎,是为了提高矿石的利用率 |
| C.反应中通入过量的空气是为了提高FeS2和SO2的转化率 |
| D.从吸收塔出来的硫酸经浓缩后可以变成发烟硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中不属于土壤酸化原因的是( )。
| A.土壤胶体吸附的H+、Al3+被其他阳离子交换 |
| B.微生物、细菌在利用土壤中的有机物时,会产生二氧化碳和多种有机酸 |
| C.微生物、细菌在利用土壤中物质时,将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸 |
| D.土壤有机物中的氮被微生物分解生成氨的氨化过程,会使土壤的pH升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com