现有一块质量为10g的金属镁样品,经测定它的表面已有部分被氧化成氧化镁,将该样品投入到100mL密度为1.14g?mL-1的盐酸中,恰好完全反应并收集到0.5g氢气.求:
(1)该金属样品中镁的质量;
(2)该盐酸的物质的量浓度.
【答案】
分析:反应的方程式有:MgO+2HCl=MgCl
2+H
2O,Mg+2HCl=MgCl
2+H
2↑,根据反应方程式计算10g的金属镁样品中氧化镁和镁的质量,进而计算盐酸的物质的量浓度.
解答:解:n(H
2)=
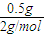
=0.25mol,
设10g的金属镁样品中含有xmolMg,ymolMgO,
Mg+2HCl=MgCl
2+H
2↑
1 2 1
x 2x x
MgO+2HCl=MgCl
2+H
2O
1 2
y 2y
则:
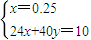
解之得:

(1)m(Mg)=0.25mol×24g/mol=6g,
答:该金属样品中镁的质量为6g.
(2)n(HCl)=(2x+2y)mol=(0.5+0.2)mol=0.7mol,
c(HCl)=
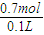
=7mol/L,
答:该盐酸的物质的量浓度为7mol/L.
点评:本题考查混合物的计算,题目难度不大,注意根据有关反应的方程式计算相关物理量.

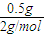 =0.25mol,
=0.25mol,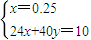

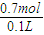 =7mol/L,
=7mol/L,
