
下列事实中,能证实一元酸HR是弱电解质的是( )
A.HR溶液和KCl溶液不发生反应
B.能与水以任意比例互溶
C.0.1 mol·L-1 的HR溶液中c(R- ) =0.01 mol·L-1
D.HR属于共价化合物
科目:高中化学 来源:2017届河南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
硫酸是基础化工的重要产品,硫酸的消费量可作为衡量一个国家工业发展水平的标志。生产硫酸的主要反应为: SO2(g)+ 1/2O2(g) SO3(g)
SO3(g)
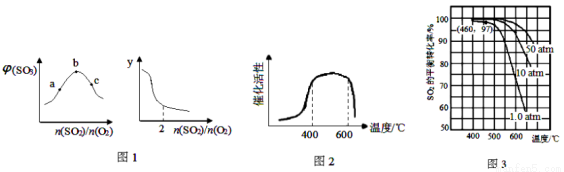
(1)恒温恒容下,平衡体系中SO3的体积分数[φ(SO3)]和y与SO2、O2的物质的量之比[n(SO2)/n(O2)]的关系如图1:则b点n(SO2)/n(O2)=_________;y为_________(填编号)。
A.平衡常数 B.SO3的平衡产率 C.O2的平衡转化率 D.SO2的平衡转化率
(2 Kp是以各气体平衡分压代替浓度平衡常数Kc中各气体的浓度的平衡常数。在400-650℃时,Kp与温度(TK)的关系为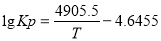 ,则在此条件下SO2转化为SO3反应的△H_________(填“>0”或“<0”)。
,则在此条件下SO2转化为SO3反应的△H_________(填“>0”或“<0”)。
(3)①该反应的催化剂为V2O5,其催化反应过程为:
SO2+ V2O5 SO3+V2O4 K1
SO3+V2O4 K1
1/2 O2+V2O4  V2O5 K2
V2O5 K2
则在相同温度下2SO2(g)+ O2 (g)  2SO3 (g)的平衡常数K=________(以含K1、K2的代数式表示)。
2SO3 (g)的平衡常数K=________(以含K1、K2的代数式表示)。
②V2O5加快反应速率的原因是___________,其催化活性与温度的关系如右图2:
(4)在7.0% SO2、11% O2、82% N2(数值均为气体体积分数)时,SO2平衡转化率与温度、压强的关系如图3,则列式计算460℃、1.0 atm下,SO2 (g)+l/2 O2 (g)  SO3 (g)的Kp=_________(己知:各气体的分压=总压×各气体的体积分数)。
SO3 (g)的Kp=_________(己知:各气体的分压=总压×各气体的体积分数)。
(5)综合第(3)、(4)题图给信息,工业生产最适宜的温度范围为____________,压强通常采用常压的原因是_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学试卷(解析版) 题型:选择题
已知:2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ·mol-1 ,CH4(g) + 2O2(g)= CO2(g) + 2H2O(l) △H = -890 kJ·mol-1 ,现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是
A.1:1 B.1:3 C.1:4 D.2:3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第二次月考化学卷(解析版) 题型:实验题
苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。反应原理:


实验步骤:
①下图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/ mL)。
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)仪器 a名称为 。
(2)判断甲苯己完全反应的现象是 、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是 ;苯甲酸粗产品除了可用重结晶法精制外,还可用 法。
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52 mL.V3= 23.80mL。
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是 。
②若用酚酞作指示剂,确定滴定终点的现象是 。
③产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第二次月考化学卷(解析版) 题型:选择题
利用下图装置,能完成很多电化学实验。下列有关此装置的叙述中,错误的是( )

A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流的阴极保护法
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处时,铁电极上的电极反应式为:Cu2++2e-===Cu
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处时溶液中各离子浓度都不会发生变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第二次月考化学卷(解析版) 题型:选择题
反应 A+B→C(ΔH<0)分两步进行:①A+B→X (ΔH >0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )


查看答案和解析>>
科目:高中化学 来源:2017届贵州省、贵阳一中高三上月考化学试卷(解析版) 题型:实验题
如下图所示,根据实验室制取氯气的原理和性质,回答下列问题:

(1)写出装置甲中发生反应的化学方程式: 。
装置甲中的仪器使用前需要检漏的有 (写名称)。
(2)利用装置丙制取饱和氯水并测其pH值。
①证明氯水已饱和的现象是 。
②测定饱和氯水的pH方法是 。
③若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是 。
(3)饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
i.在试管中加入过量的块状碳酸钙,再加入约20ml饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
ii.过滤,将滤液滴在有色布条上,发现其漂白性更强;
iii.为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立刻产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2气体。
试解释可以在饱和氯水中加入石灰石制备HClO的原因: 。(用有关的方程式结合文字回答)
②试根据所学知识推测,在ii的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为 (写化学式)。
③写出步骤iii中第一份滤液发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高二9月月考化学卷(解析版) 题型:选择题
如图是关于反应A2(g)+B2(g)  2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是
2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是
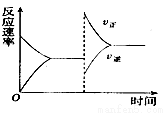
A.温度、压强不变,充入一些A2(g)
B.压强不变,降低温度
C.压强、温度不变,充入一些与之不反应的惰性气体
D.升高温度,同时加压
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高二9月月考化学卷(解析版) 题型:选择题
常温下,能在铁制容器中贮存的物质是
A、浓盐酸 B、氯化铁溶液 C、浓硫酸 D、硫酸铜溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com