
下表所列是元素周期表部分短周期的主族元素
|
|
W |
X |
Y |
|
|
R |
|
|
|
Z |
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。
已知①N2(g)+2O2(g)=N2O4(l) △H1=—195kJ•mol—1
②N2H4(l) +O2(g)=N2(g)+2H2O(g) △H2=—534.2kJ•mol—1
写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0L恒容密闭容器中充入1.00 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
|
t/s |
0 |
50 |
150 |
250 |
350 |
|
n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
相同温度下,起始时向容器中充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
(15分)
(1) (2分)
(2分)
(2)CH2=CH2 (2分)
(3)Al2O3+N2+3C 2AlN+3CO(3分)
2AlN+3CO(3分)
(4)c(NO3—)>c(NH4+)>c(H+)>c(OH-) (顺序错,漏均不得分)(2分)
(5)2N2H4(l) + N2O4(l)= 3N2(g) + 4H2O(g) ΔH=—873.4 kJ/mol(3分)
(6) <(1分)
因为Qc= >K=
>K=  ;所以逆反应速率大于正反应速率。(2分)
;所以逆反应速率大于正反应速率。(2分)
【解析】
试题分析:(1)地壳中含量最多的金属元素是Al,则R、W、X、Y、Z分别是铝、碳、氮、氧、氯,Cl原子核内核电荷数为+17,核外电子层结构为287;(2)碳和氢形成烃,6原子烃分子为乙烯,乙烯的结构简式为CH2=CH2;(3)根据题意,Al2O3、N2、C在高温下反应,可以生成AlN、CO,则反应式为Al2O3+N2+3C 2AlN+3CO;(4)根据题意,HNO3与NH3反应,生成NH4NO3,NH4NO3是盐,根据电解质的电离、盐类水解规律可知,溶液中c(NO3—)>c(NH4+)>c(H+)>c(OH-);(5)根据盖斯定律,由②×2—①可得,2N2H4(l)
+ N2O4(l)= 3N2(g) + 4H2O(g) ΔH=—873.4 kJ/mol;(6)根据图表可知,
2AlN+3CO;(4)根据题意,HNO3与NH3反应,生成NH4NO3,NH4NO3是盐,根据电解质的电离、盐类水解规律可知,溶液中c(NO3—)>c(NH4+)>c(H+)>c(OH-);(5)根据盖斯定律,由②×2—①可得,2N2H4(l)
+ N2O4(l)= 3N2(g) + 4H2O(g) ΔH=—873.4 kJ/mol;(6)根据图表可知,
PCl5(g) PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
各组分的起始浓度(mol•L—1) 0.50 0 0
各组分的变化浓度(mol•L—1) 0.10 0.10 0.10
各组分的平衡浓度(mol•L—1) 0.40 0.10 0.10
平衡时K= =
=
温度不变,平衡常数不变,若起始时充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,则三者的起始浓度为0.5mol/L、0.10mol/L、0.20mol/L,Q= =
= >
> ,说明此时反应必须向逆反应方向进行,才能达到该温度下的化学平衡,所以此时逆反应速率大于正反应速率。
,说明此时反应必须向逆反应方向进行,才能达到该温度下的化学平衡,所以此时逆反应速率大于正反应速率。
考点:考查物质结构和元素周期律、氧化还原反应、质量守恒定律、铝氮碳氧元素及其化合物、盐类水解、电解质溶液中离子浓度大小关系、热化学方程式、盖斯定律、化学平衡的计算与化学反应进行的方向等相关知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | Y | ||
| R | Z |
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学三轮复习排查 专题4物质结构 元素周期律练习卷(解析版) 题型:填空题
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
元素代号ABCDE
原子半径/nm0.160.1430.1020.0890.074
主要化合价+2+3+6,-2+2-2
(1)在下表中标出上述五种元素在元素周期表中的对应位置(用元素符号)。
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。

(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省高一3月月考化学试卷(解析版) 题型:填空题
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为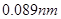 )
)

(1)B与D形成的化合物是 ;A和E形成的化合物是 。(填离子化合物或共价化合物)
(2)C的氢化物的电子式为 。
(3)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为: ;
(4)上述五种元素的最高价氧化物对应水化物的酸性最强的是 (填化学式);
(5)C、E形成的化合物为 、 (填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com