
分析 强电解质在溶液中完全电离,电离方程式用“=”,氯化铝完全电离出铝离子和氯离子,氢氧化钙完全电离出钙离子和氢氧根离子,硫酸完全电离出氢离子和硫酸根离子,据此写出其电离方程式.
解答 解:AlCl3是盐,属于强电解质,在溶液中完全电离,其电离方程式为:AlCl3=Al3++3Cl-,
Ca(OH)2是二元强碱,为强电解质,完全电离,电离方程式:Ca(OH)2=Ca2++2OH-;
H2SO4是强酸,属于强电解质,在溶液中完全电离,其电离方程式为:H2SO4=2H++SO42-,
故答案为:AlCl3=Al3++3Cl-;Ca(OH)2=Ca2++2OH-;H2SO4=2H++SO42-.
点评 本题考查了电离方程式的书写,题目难度不大,注意掌握强弱电解质的概念及电离方程式的书写方法,试题注重了基础知识的考查,有利于培养学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
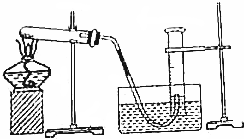
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在2L水中溶有80克的NaOH | B. | 80克NaOH溶于2L水配成的溶液 | ||
| C. | 每升溶液中含有80克NaOH | D. | 每2L溶液中含有80克NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 H2O2$\frac{\underline{\;催化剂\;}}{\;}$2 H2O+O2↑ | B. | 2 Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O | ||
| C. | Fe2O3+3 CO$\frac{\underline{\;高温\;}}{\;}$2 Fe+3 CO2 | D. | Cl2+H2O═HCl+HclO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液(FeCl3):Fe粉 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | SO2(HCl):NaOH溶液 | D. | NaHCO3溶液(Na2CO3):Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
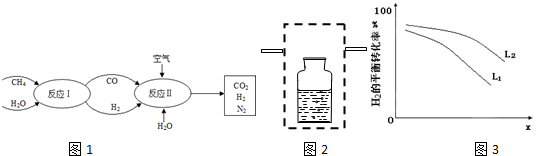
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电能是一级能源 | B. | 水煤气是二级能源 | ||
| C. | 天然气是二级能源 | D. | 水能是二级能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
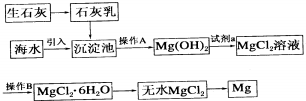
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com