
����Ŀ���¶�ΪT1ʱ���������ݻ���Ϊ1L�ĺ����ܱ������н�������Ӧ: 2NO2(g)![]() 2NO(g)+O2(g) (����Ӧ����)��ʵ����:v��=v(NO2)����=k��c2(NO2)��v��=v(NO)����= 2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣
2NO(g)+O2(g) (����Ӧ����)��ʵ����:v��=v(NO2)����=k��c2(NO2)��v��=v(NO)����= 2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣
����˵����ȷ����
���� ��� | ���ʵ���ʼŨ�ȣ�mol��L��1�� | ���ʵ�ƽ��Ũ�ȣ�mol��L��1�� | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
�� | 0.6 | 0 | 0 | 0.2 |
�� | 0.3 | 0.5 | 0.2 | |
�� | 0 | 0.5 | 0.35 | |
A. ��kΪ�÷�Ӧ�Ļ�ѧƽ�ⳣ��������k=k��:k��
B. ��ƽ��ʱ�����������������е���ѹǿ֮��Ϊ20��17
C. ����������ʼƽ�������ƶ�����ƽ��ʱ����������NO2��ת���ʱ��������е�С
D. ���ı��¶�ΪT2,��T2>T1,��k��:k��<0.8
���𰸡�C
��������ƽ��ʱ�������淴Ӧ������ȣ�����![]() ������K=c2(NO)c(O2)/c2(NO2)= k��/ k����A���������ݷ�Ӧ����ʽ����������
������K=c2(NO)c(O2)/c2(NO2)= k��/ k����A���������ݷ�Ӧ����ʽ����������![]() ��ƽ��Ũ�ȿ�֪��ƽ��ʱ��c(NO)=0.4 mol��L��1��c(NO2)=0.2 mol��L��1����
��ƽ��Ũ�ȿ�֪��ƽ��ʱ��c(NO)=0.4 mol��L��1��c(NO2)=0.2 mol��L��1����![]() �¶��£��÷�Ӧ��ƽ�ⳣ��
�¶��£��÷�Ӧ��ƽ�ⳣ��![]() ����������Ũ����QC=0.2��0.52/0.32=0.56<0.8,��Ӧ�����ƶ����������������1mol,���������з�Ӧ������������������С��0.85mol�����Դ�ƽ��ʱ�����������������е���ѹǿ֮�ȴ���20��17��B����������������ڷ�Ӧ��֪��NO2��ת����Ϊ0.4/0.6=2/3,������������NO2��ת����ҲΪ2/3����Ӧ������У���÷�Ӧ��ƽ�ⳣ��Ϊ��
����������Ũ����QC=0.2��0.52/0.32=0.56<0.8,��Ӧ�����ƶ����������������1mol,���������з�Ӧ������������������С��0.85mol�����Դ�ƽ��ʱ�����������������е���ѹǿ֮�ȴ���20��17��B����������������ڷ�Ӧ��֪��NO2��ת����Ϊ0.4/0.6=2/3,������������NO2��ת����ҲΪ2/3����Ӧ������У���÷�Ӧ��ƽ�ⳣ��Ϊ��
2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
��ʼ�� 0.3 0.5 0.2
�仯�� 0.2 0.2 0.1
ƽ���� 0.1 0.7 0.3
ƽ�ⳣ��Ϊk=0.3��0.72/0.12=14.7>8,������������NO2��ת����С��2/3��������������ʼƽ�������ƶ�����ƽ��ʱ����������NO2��ת���ʱ��������е�С��C��ȷ�����ڸ÷�Ӧ����Ӧ�����ȷ�Ӧ���¶�![]() ������
������![]() ʱƽ�ⳣ��������k��:k��>0.8����ȷѡ��C��
ʱƽ�ⳣ��������k��:k��>0.8����ȷѡ��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ�â�Ϊ�״�ȼ�ϵ��(�������ҺΪKOH��Һ)��ͨ��װ�â�ʵ�������϶�ͭ��
��1��b��Ӧͨ��(�CH3OH����O2��)��a���缫�Ϸ����ĵ缫��Ӧʽ����
��2����ƽ�����װ�â�����Һ��pH(��д�������С�����䡱����ͬ)��װ�â���Cu2�������ʵ���Ũ����
��3����ͭ�缫������С6.4 g�������ı���µ�O2�����Ϊ��
��4������װ��I�е������Һ����������Һ�����ڹ���������H+ �����缫���a����b������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ԫ���� H2Y ��Һ�еμ� KOH ��Һ�����û����Һ�� pH ������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ�������й�˵���������(����)
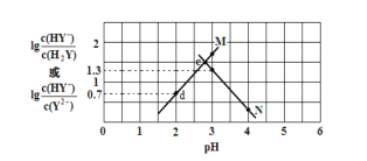
A. ���� M ��ʾ pH��![]() �ı仯��ϵ
�ı仯��ϵ
B. Ka2(H2Y)=10-4.3
C. d ����Һ��: c(H+)��c(OH -)��2c(Y2-)�� c(HY-)��c(K+)
D. ���� e ����Һ��: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɷ�����X�ϳ�һ�ֹ��ܸ߷���H�Ĺ������¡�(���ֲ���ϳ�·�ߡ���Ӧ������ȥ)��
����A��һ�ȴ��H���������ΪC7H5NO
��֪��I������X�������Dz��������ͼ��ͼ��ʾ
�������ѧ֪ʶ�뱾��������Ϣ�ش���������
��1��H�Ľṹ��ʽ��_____________��(2)��Ӧ�ۺܵ͢����ͷֱ���_____________��_____________
��3����Ӧ�ݵĻ�ѧ����ʽ��__________________________
��4����˾ƥ���к��������ŵ�����Ϊ__________________________
��5��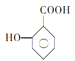 ��һ��ͬϵ��
��һ��ͬϵ��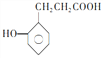 �ж���ͬ���칹�壬���з�������Ҫ��Ĺ���_____________��(�����������칹)��д�����к˴Ź�������Ϊ6��壬�ҷ������Ϊ2��2��2��2��1��1�Ľṹ��ʽ_____________
�ж���ͬ���칹�壬���з�������Ҫ��Ĺ���_____________��(�����������칹)��д�����к˴Ź�������Ϊ6��壬�ҷ������Ϊ2��2��2��2��1��1�Ľṹ��ʽ_____________
������ NaHCO3��Ӧ�ų�CO2
������FeCl3��Һ������ɫ��Ӧ
�۱����ϵ�һȡ����������
��6�����úϳɷ�Ӧ����ͼ��ʾ����A����������ϳ�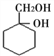 ������ķ�����_______________
������ķ�����_______________
����  ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Է�ˮ�е�Cr2O72-��ת��ΪCr3+��ȥ��ʵ�����õ�ⷨģ��ù��̣�������±���ʾ(ʵ�鿪ʼʱ��Һ���Ϊ50mL,Cr2O72-����ʼŨ�ȡ���ѹ�����ʱ�����ͬ)������˵���У�����ȷ����
ʵ�� | �� | �� | �� |
������� | ����������Ϊʯī | ����������Ϊʯī�� �μ�1mLŨ���� | ����Ϊʯī������Ϊ�����μ�1mLŨ���� |
Cr2O72-��ȥ����/% | 0.922 | 12.7 | 57.3 |
A. �Ա�ʵ��٢ڿ�֪������pH�������Cr2O72-��ȥ����
B. ʵ����У�Cr2O72-�������ŵ�ĵ缫��Ӧʽ��Cr2O72-+6e-+14H+�T2Cr3++7H2O
C. ʵ����У�Cr2O72-ȥ������ߵ�ԭ����Cr2O72-+6 Fe2++14H+�T2Cr3++6Fe3++7H2O
D. ʵ����У������ϵ�·��ÿͨ��6mol���ӣ�����1molCr2O72-����ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����и������������FeƬ��ʴ���������˳���ǣ�������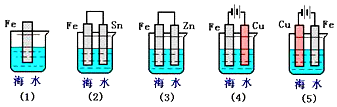
A.�ݢڢ٢ۢ�
B.�ݢ٢ڢܢ�
C.�ܢڢ٢ۢ�
D.�ܢۢ٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��I�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮������ϵ��ͼ��ʾ(���ַ�Ӧ�������û���г�)����֪HΪ����������,F�Ǻ��ɫ������ˮ�ij�������A��B��C��D��E��F���������о���ͬһ��Ԫ�ء�
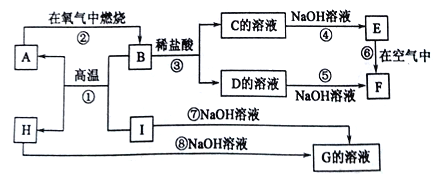
����д���пհ���
(1)A��B��C��D��E��F����������������ͬһ��Ԫ�ص�������____________��
(2)д��C��H�Ļ�ѧʽ��C___��H______��
(3)д����Ӧ�١����Ļ�ѧ����ʽ����Ӧ��_______________����Ӧ��________________��
(4)��Ӧ�������г��ֵ�������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� ( )
A. ![]() ���ۣ�CH4��ȼ����Ϊ801��3 kJ��mol
���ۣ�CH4��ȼ����Ϊ801��3 kJ��mol
B. ![]() (����Ϊ��ĩ״)���ۣ�����Ʒ�ں���Ķ�������ת��Ϊ��������
(����Ϊ��ĩ״)���ۣ�����Ʒ�ں���Ķ�������ת��Ϊ��������
C. ϡ��Һ����![]() ���ۣ��������백ˮ��ϡ��Һ��Ϻ�������1mol H20�����ų�57��3kJ������
���ۣ��������백ˮ��ϡ��Һ��Ϻ�������1mol H20�����ų�57��3kJ������
D. ![]() AH=һ393��5 kJ/mol,
AH=һ393��5 kJ/mol,![]() ���ۣ���ͬ�����½��ʯ���ʱ�ʯī�ȶ�
���ۣ���ͬ�����½��ʯ���ʱ�ʯī�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����(Ru)����������Ⱦ������̫���ܵ�صĹ���ԭ��������з�������Ҫ��Ӧ��ͼ��ʾ������˵���������
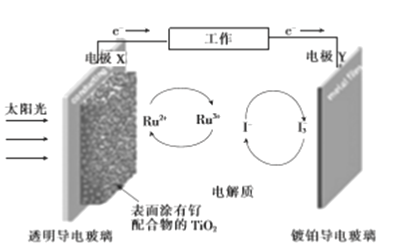
A. ��ع���ʱ������ת��Ϊ���ܣ�XΪ��صĸ���
B. �Ʋ����粣���Ϸ���������Ӧ����I-
C. �������Һ�з�����Ӧ:2Ru3++3I-![]() 2Ru2++I3-
2Ru2++I3-
D. ��ع���ʱ���������Һ��I-��I3-��Ũ�Ȼ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com