
【题目】通过石油裂化和裂解可以得到乙烯、丙烯、甲烷等重要化工基本原料。目前,仅有10%产量的石油转化为化工、医药等行业的基本原料加以利用。用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:

已知:CH3CHO![]() CH3COOH
CH3COOH
根据以上材料和你所学的化学知识回答下列问题:
(1)由CH2=CH2制得有机物A的化学反应方程式是_____________,反应类型是___________。
(2)有机物B中含有的官能团为_________、_________ (填名称)。
(3)写出A与B合成丙烯酸乙酯的反应方程式是___________________________,反应类型是______。其中浓硫酸所起的作用是___________。
(4)在沙漠中,喷洒一定量的聚丙烯酸乙酯,能在地表下30~50厘米处形成一个厚0.5厘米的隔水层,既能阻断地下盐分上升,又有拦截蓄积雨水的作用,可使沙漠变成绿洲。写出丙烯酸乙酯在引发剂作用下聚合成聚丙烯酸乙酯的化学方程式____________________,反应类型是____________。
【答案】 CH2=CH2+H2O![]() CH3CH2OH 加成反应 碳碳双键 羧基 CH2=CHCOOH+HOCH2CH3
CH3CH2OH 加成反应 碳碳双键 羧基 CH2=CHCOOH+HOCH2CH3![]() CH2=CHCOOCH2CH3+H2O 取代反应(或酯化反应) 催化剂、吸水剂 nCH2=CHCOOCH2CH3
CH2=CHCOOCH2CH3+H2O 取代反应(或酯化反应) 催化剂、吸水剂 nCH2=CHCOOCH2CH3![]() 加成聚合反应(或加聚反应)
加成聚合反应(或加聚反应)
【解析】试题(1)乙烯含有碳碳双键,能与水发生加成反应生成乙醇,则A是乙醇,反应的化学方程式为CH2=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。
(2)有机物B与乙醇反应生成丙烯酸乙酯,则B是丙烯酸,结构简式为CH2=CHCOOH,含有的官能团为碳碳双键、羧基。
(3A与B发生酯化反应生成丙烯酸乙酯的反应方程式是CH2=CHCOOH+HOCH2CH3
![]() CH2=CHCOOCH2CH3+H2O。其中浓硫酸所起的作用是催化剂、吸水剂。
CH2=CHCOOCH2CH3+H2O。其中浓硫酸所起的作用是催化剂、吸水剂。
(4)丙烯酸乙酯中含有碳碳双键,能发生加聚反应生成高分子化合物,则在引发剂作用下聚合成聚丙烯酸乙酯的化学方程式为nCH2=CHCOOCH2CH3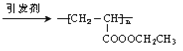 。
。


科目:高中化学 来源: 题型:
【题目】下列四个试管中,过氧化氢分解产生氧气的反应速率最快的是 ( )
试管 | 温度 | 过氧化氢溶液浓度 | 催化剂 |
A | 常温 | 3% | — |
B | 常温 | 6% | — |
C | 水浴加热 | 3% | — |
D | 水浴加热 | 6% | MnO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,PbO2与Cr3+反应,产物是Cr2O72﹣和Pb2+ , 则与1mol Cr3+反应所需PbO2的物质的量为( )
A.3.0mol
B.1.5mol
C.1.0mol
D.0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 2NO2(g)+ CH4(g)![]() N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=
N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=![]() ] ;下列说法不正确的是
] ;下列说法不正确的是

A. ΔH < 0
B. X > 2
C. 400K时,反应的平衡常数为5×10-2
D. 投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25°时,乙酸和三氯乙酸的电离常数分别是:Ka(CH3COOH)═1.80×10﹣5 , Ka(CCl3COOH)═0.60,在物质的量浓度均为0.1molL﹣1的CH3COONa和CCl3COONa混合溶液中,下列关系正确的是( )
A.c(Na+)═c(CCl3COO﹣)+c(CH3COO﹣)
B.c(CCl3COO﹣)﹣c(CH3COO﹣)═c(CH3COOH)﹣c(CCl3COOH)
C.c(OH﹣)>c(CCl3COO﹣)>c(CH3COO﹣)
D.c(CH3COOH)>c(CCl3COOH)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与热能、电能等可以相互转化,下列说法正确的是
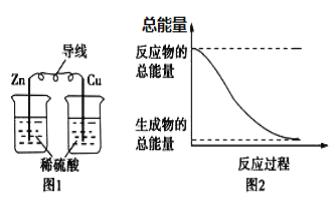
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 化学反应中能量变化的主要原因是化学键的断裂与生成
D. 中和反应中,反应物的总能量比生成物的总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 通常状况下,48gO2和O3的混合气体中含有的氧原子数目约为3NA
B. 标准状况下,4.48 L甲醛(HCHO)含有的分子数目约为2NA
C. 1L1mol·L-1CH3CH2OH溶液中含有的氧原子数目约为NA
D. 1 molMg中含有的电子数目约为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是一种在生产和生活中应用广泛的金属元素。己知:
反应Ⅰ:Fe2O3(s)+ 3H2(g)=2Fe(s)+3H2O(g) ΔH1= +89 .6kJ /mol
反应Ⅱ:4Fe2O3(s)+Fe(s)=3Fe3O4(s) ΔH2=+2833.4kJ/mol
反应Ⅲ:Fe(s)+2HCl(g)![]() FeCl2(l)+H2(g) ΔH3
FeCl2(l)+H2(g) ΔH3
(1)反应Ⅰ的平衡常数表达式K=______________,该反应在高温下进行,最易生成的副产物是________________ (填化学式)。
(2)温度为T1时,恒容密闭容器中发生反应Ⅲ,反应时间与体系压强关系如图a所示,体系温度与HCl转化率关系如图b所示。
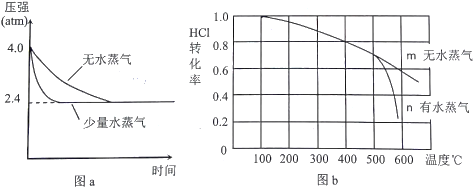
①分析图a,容器内通入少量水蒸气的作用是___________________。
②分析图b,ΔH3________0(填“>”、“<”或“=”),结合图a分析,T1=___________℃。
③分析图b,高于500℃后,曲线n发生的副反应热化学方程式为________________________________, 曲线n中HCl转化率明显降低的原因是____________________________________。
(3)①CaFeO4可制作半导体材料,向1L的高铁酸钠(Na2FeO4)溶液中加入0.0056g生石灰开始生成CaFeO4沉淀,原高铁酸钠溶液的物质的量浓度为________mol/L。已知Ksp(CaFeO4)=4.54×10-9,溶液体积变化忽略不计。
②用K2FeO4代替MnO2制备的碱性干电池(KOH做电解液)具有能量密度大、寿命长、无污染等优点,正极反应生成Fe2O3,写出正极的电极反应式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10﹣8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10﹣5 mol/L.若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c(K+)>c(NO3﹣)>c(Ag+)>c(Cl﹣)>c(I﹣)
B.c(K+)>c(NO3﹣)>c(Cl﹣)>c(Ag+)>c(I﹣)
C.c(K+)>c(NO3﹣)>c(Ag+)=c(Cl﹣)+c(I﹣)
D.c(NO3﹣)>c(K+)>c(Ag+)>c(Cl﹣)>c(I﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com