


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
 25摄氏度时,在20ml 0.1mol/L NaOH溶液中逐滴加入 0.2mol/L的醋酸溶液,曲线如图所示有关离子浓度关系的比较中,正确的是( )
25摄氏度时,在20ml 0.1mol/L NaOH溶液中逐滴加入 0.2mol/L的醋酸溶液,曲线如图所示有关离子浓度关系的比较中,正确的是( )| A、在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、在A点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| C、在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| D、在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池是把电能转化为化学能的装置 |
| B、原电池中电子流出的一极是正极发生氧化反应 |
| C、原电池的两极发生的反应均为氧化还原反应 |
| D、形成原电池后,原电池中的阳离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
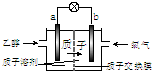 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )| A、a极为电池的正极 |
| B、电池正极的电极反应:4H++O2+4e-=2H2O |
| C、电池工作时电子由b极沿导线经灯泡再到a极 |
| D、设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6q×6.02×1023库仑的电量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- | ||
B、在
| ||
| C、水电离出的c(H+)=1×10-13mol/L的溶液中,K+、CO32-、Cl-、S2- | ||
| D、在pH=3的无色溶液中:Fe3+、C1-、NO3-、A13+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银氨溶液中加入足量盐酸产生沉淀:[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O |
| B、在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解:3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O |
| C、碳酸钠溶液中通入少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32- |
| D、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一组 | He-268.8 | (A)-249.5 | Ar-185.8 | Kr-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | (B) 58.7 | I2 184.0 |
| 第三组 | (C) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | (D)-42.0 | H2Te-1.8 |
| A、A、B、C的化学式分别为Ne2、Br2、HF |
| B、第二组物质在反应中只表现氧化性 |
| C、第三组物质中C的沸点最高,是因为C分子内存在氢键 |
| D、第四组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com