
| A. | 碘化钾溶液中加入浓溴水2I-+Br2═2Br-+I2 | |
| B. | 小苏打与盐酸反应CO32-+2H+═CO2↑+H2O | |
| C. | 氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
分析 A.发生氧化还原反应,遵循电子、电荷守恒;
B.小苏打为碳酸氢钠;
C.反应生成氯化亚铁、遵循电子、电荷守恒;
D.一水合氨在离子反应中保留化学式.
解答 解:A.碘化钾溶液中加入浓溴水的离子反应为2I-+Br2═2Br-+I2,故A正确;
B.小苏打与盐酸反应的离子反应为HCO3-+H+═CO2↑+H2O,故B错误;
C.氯化铁溶液中加入铁粉的离子反应为2Fe3++Fe═3Fe2+,故C正确;
D.AlCl3溶液中加入足量的氨水的离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选AC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2与2 mol NaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3.10H2O组成的混合物0.05 mol,溶于水后加入50 mL 1 mol/L的硫酸恰好完全反应,则原混合物中各成分的物质的量之比可为任意值 | |
| C. | 将mg CO和H2的混合气体在足量氧气中完全燃烧,再将燃烧后的气体用足量Na2O2充分吸收,Na2O2增重mg | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
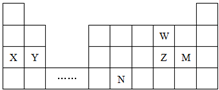
| A. | 原子半径:X>Y>W | |
| B. | 单质的氧化性:W>Z | |
| C. | 溴与元素M同主族,气态氢化物的稳定性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4+H2O2+3H2SO4=K2SO4+2MnSO4+4H2O+3O2↑ | |
| B. | 2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+6H2O+4O2↑ | |
| C. | 2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑ | |
| D. | 2KMnO4+7H2O2+3H2SO4=K2SO4+2MnSO4+10H2O+6O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
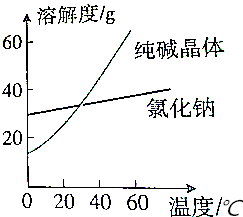
| A. | 蒸馏法 | B. | 苹取法 | C. | 结晶法 | D. | 分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
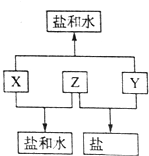 已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.
已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.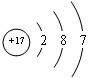 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
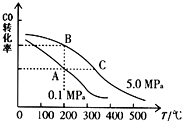 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
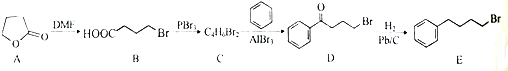
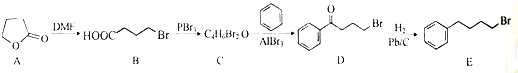
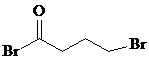 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.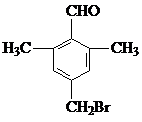 等.
等.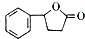 的合成路线流程图(无机试剂任用).合成路线流程图示例如下
的合成路线流程图(无机试剂任用).合成路线流程图示例如下查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com