
| A、S2Cl2的结构简式:Cl-S-S-Cl |
| B、S2Cl2和水反应中,氧化剂还原剂物质的量之比为1:1 |
| C、S2Cl2和NaOH水溶液反应,氧化与还原产物物质的量之比为1:1 |
| D、13.5g S2Cl2和NaOH反应电子转移数为0.1NA |
 ;
;| 13.5g |
| 135g/mol |
 ,则结构简式为Cl-S-S-Cl,故A正确;
,则结构简式为Cl-S-S-Cl,故A正确;| 13.5g |
| 135g/mol |


科目:高中化学 来源: 题型:
A、热化学方程式C2H2(g)+
| ||
| B、H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol,表示含1molNaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 | ||
| C、少量的钠投入足量的水中:2Na+2H2O═2Na++2OH-+H2↑ | ||
| D、向明矾KAl(SO4)2溶液中滴入氢氧化钡溶液,至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Ac-)>c(Na+) |
| B、c(HAc)>c(Ac-) |
| C、2c(H+)=c(Ac-)-c(HAc) |
| D、c(HAc)+c(Ac-)=0.01mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢的摩尔质量是1g/mol |
| B、1个氮分子的摩尔质量为28g |
| C、水的摩尔质量为18g |
| D、NO3- 的摩尔质量为62g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
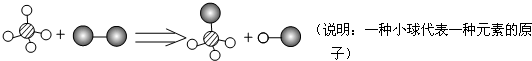
| A、图示中的反应物都是单质 |
| B、该反应属于置换反应 |
| C、图示中共有4种物质 |
| D、该图示不符合质量守恒定律 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸 | B、盐酸 |
| C、氢氧化钠溶液 | D、氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com