(2011?怀化一模)化学一化学与技术
我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)
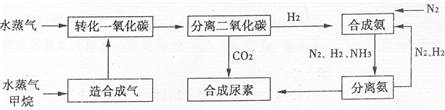
请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①
;
②
.
(2)依据流程圈,判断下列说法正确的是
C
C
.
A.在转化CO的过程中使用催化剂,可以提高CO的转化率
B.进入分离二氧化碳装置的气体有2种
C.N
2、H
2的循环使用,提高了原子的利用率
D.二氧化碳与氨合成尿素属于人工固氮
E.流程中的原料有3种取之不尽,用之不完
(3)合成氨选择的外界条件是:催化剂,20~50MPa的压强,500℃的温度.选择该温度的主要原因是
500℃的温度反应速率较快,催化剂活性最高
500℃的温度反应速率较快,催化剂活性最高
.
(4)已知制造合成气的反应为CH
4(g)+H
2O(g)?CO(g)+3H
2(g),该反应的平衡常数表达式为K=
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
.降低温度K减小,则正反应是一个
吸
吸
热反应.当造合成气的反应中甲烷的转化率为75%.合成氨中氢气的转化率为40%(其他过程的损失不计)以5.60xlO
7L甲烷为原料能够合成
4.48xlO7L
4.48xlO7L
L氨气.(假设体积均在标准状况下测定)



