
我国已研制出一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为 。
(2)S与O为同主族元素,其中电负性较大的是 ;H2S分子中S原子杂化轨道类型为 ;试从结构角度解释H2SO4的酸性大于H2SO3的酸性: 。
(3)Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应可以生成NH2—NH2,NH2—NH2能否作配体? (填“能”或“否”)。
②CaO晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含有Ca2+数为 ;欲比较CaO与NaCl的晶格能大小,需考虑的数据是 。
(1)3d54s2
(2)O sp3 H2SO4的非羟基氧原子数目大于H2SO3
(3)①能 ②4 Ca2+、O2-与Na+、Cl-的离子半径与离子所带的电荷数
【解析】(1)Mn位于周期表第四周期第ⅦB族,其基态价层电子排布式为3d54s2。(2)O的电负性较大;H2S中心原子S上有两对孤电子对,H2S分子中S原子杂化轨道类型为sp3杂化;H2SO3和H2SO4可表示成(HO)2SO和(HO)2SO2,H2SO4的非羟基氧原子数目大于H2SO3,故H2SO4的酸性大于H2SO3的酸性。(3)①由于H2N—NH2中的氮原子上有孤电子对可以作为配体和其他离子形成配合物。②由NaCl的晶胞结构可知一个CaO晶胞中含有4个Ca2+;晶格能的大小与离子半径和离子所带的电荷数有关。


科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) ===2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
②3CO(g)+Fe2O3(s) ===2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
则2Fe2O3(s)+3C(s) ===4Fe(s)+3CO2(g) ΔH= kJ·mol-1。
(2)天然气(以甲烷计)在工业生产中用途广泛。甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+2H2O(g) ===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解三池的应用(解析版) 题型:选择题
下列叙述中不正确的是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池的正极上发生氧化反应,负极上发生还原反应
C.电镀时,电镀池里的阳极材料发生氧化反应
D.用原电池作电源进行电解时,电子从原电池负极流向电解池阴极
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学甲烷、乙烯及其同系物、苯及其同系物(解析版) 题型:选择题
符合下列条件的烃的一氯代物共有(不考虑立体异构)
①分子中碳元素与氢元素的质量之比为21:2;②含一个苯环;③相对分子质量小于150。
A.2种 B.3种C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是 。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是 。
(3)X与Z中电负性较大的是 。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为 ,此离子中所含化学键的类型是 ,X—Z—X的键角 109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。
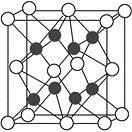 (4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为 ,与一个X离子距离最近的所有的Y离子为顶点的几何体为 。该化合物与MgO相比,熔点较高的是 。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为 ,与一个X离子距离最近的所有的Y离子为顶点的几何体为 。该化合物与MgO相比,熔点较高的是 。
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为 g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及阿伏伽德罗常数(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2晶体中含有0.4NA个离子
D.铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及相关计算(解析版) 题型:选择题
某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示:下列说法不正确的是
盐酸/mL | 50 | 50 | 50 |
固体混合物质量/g | 9.2 | 15.7 | 27.6 |
标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A.盐酸的物质的量浓度为3.0 mol/L
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入9.2 g固体混合物时盐酸过量
D.15.7 g固体混合物恰好与盐酸完全反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的检验(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结 论 |
A | 将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2试样已变质 |
B | 将少量某无色气体通入澄清石灰水 | 出现白色沉淀 | 该气体一定是CO2 |
C | 分别测定常温下0.1 mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | pH:Na2SiO3> Na2CO3 | 非金属性:Si>C |
D | 向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中,滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(解析版) 题型:选择题
下列说法正确的是
A.反应2Mg+CO22MgO+C ΔH<0从熵变角度看,可以自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com