
| A. | 碱式滴定管只用水洗,而未用待测液润洗 | |
| B. | 锥形瓶中残留有蒸馏水 | |
| C. | 酸式滴定管滴定前尖嘴处有气泡,滴定后气泡消失 | |
| D. | 滴定前仰视刻度读数,滴定后俯视刻度读数 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.碱式滴定管只用水洗,而未用待测液润洗,则消耗盐酸较少,测定结果偏小,故A错误;
B.锥形瓶用蒸馏水洗净后,待测液的物质的量不变,标准液的体积不变,结果不变,故B错误;
C.滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(待测)偏大,故C正确;
D.滴定前仰视刻度读数,滴定后俯视刻度读数,导致测量体积偏小,滴定结果偏小,故D错误.
故选C.
点评 本题主要考查了中和滴定操作的误差分析,为高频考点,侧重考查学生分析能力和实验能力,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等体积、等物质的量浓度的氨水与盐酸混合 | |
| B. | 常温下,pH=8的氨水与pH=6的硝酸等体积混合 | |
| C. | 常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合 | |
| D. | c(H+)=c(OH-)=10-6 mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
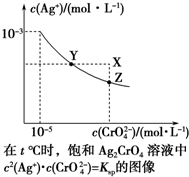 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-11 | |
| B. | 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点 | |
| C. | 在t℃,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO${\;}_{4}^{2-}$(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001 mol•L-1 AgNO3溶液滴定20 mL 0.001 mol•L-1 KCl和0.001 mol•L-1的K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和AgCl水溶液中加入少量的NaCl固体,Ksp(AgCl)变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 25℃时,当溶液中c(Ag+)×c(Cl-)=Ksp(AgCl)时,此溶液为AgCl的饱和溶液 | |
| D. | 将固体AgCl加入到浓KI溶液中,部分AgCl转化为AgI,故AgCl溶解度小于AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
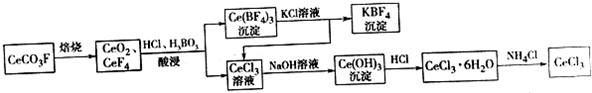
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
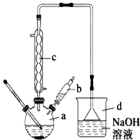
 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
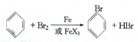
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com