
| A. | H+、OH-、Na+、Cl- | B. | K+、NO3-、Cu2+、Cl- | ||
| C. | Ba2+、SO42-、Na+、OH- | D. | Fe3+、OH-、NH4+、HCO3- |
分析 A.氢离子与氢氧根离子反应;
B.四种离子之间不发生反应,能够大量共存;
C.钡离子与硫酸根离子反应生成难溶物硫酸钡;
D.铁离子与氢氧根离子、碳酸氢根离子,氢氧根离子与铵根离子、碳酸氢根离子反应反应.
解答 解:A.H+、OH-之间反应生成水,在溶液中不能大量共存,故A错误;
B.K+、NO3-、Cu2+、Cl-之间不发生反应,在溶液中可以大量共存,故B正确;
C.Ba2+、SO42-之间反应生成硫酸钡沉淀,在溶液中不能大量共存,故C错误;
D.Fe3+与OH-、HCO3-反应,OH-与NH4+、HCO3-发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,题目难度中等,明确离子反应发生条件为解答关键,注意掌握离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
序号 | 实验操作 | 实验现象 | 实验结论 |
| 1 | 将镁条投入5ml蒸馏水 | 微量气泡 | |
| 2 | 将镁条投入5ml饱和NaHCO3溶液中 | Mg与NaHCO3溶液剧烈反应 | |
| 3 | 将镁条投入5ml pH=8.4NaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
实验步骤 | 想象和结论 |
| 大试管中加入擦去氧化膜的镁条 加入碳酸氢钠饱和溶液,用湿润的红色石蕊试纸在锥形瓶口检验 | 若试纸变红,气体中有CO2若试纸不变红,气体中无CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2Cl | B. | CH3CH2CHClCH2CH3 | ||
| C. | 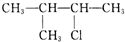 | D. | 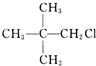 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
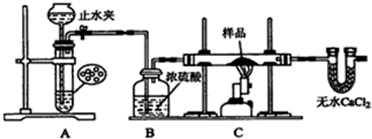
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
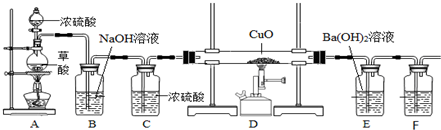
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量氯化钴晶体溶于一定浓度的盐酸溶液呈紫色,加热后溶液颜色变成蓝色 | |
| B. | 中和热测定实验中,环形玻璃搅拌棒不能用铜质搅拌棒代替 | |
| C. | 容量瓶、分液漏斗、滴定管使用时都必须检查是否漏水 | |
| D. | 滴定管水洗后必须烘干才能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
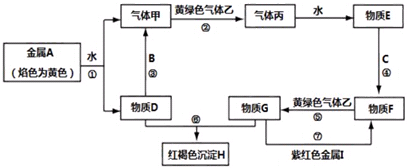
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com