
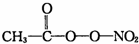 (PAN)等二次污染物.
(PAN)等二次污染物.分析 (1)Sn是33号元素,其原子核外有33个电子,根据构造原理书写其基态原子核外电子排布式;
(2)当中心原子有空轨道,配离子含有孤对电子时,能形成配位键;根据等电子体原理可写出与CN一互为等电子体的化合物分子式;
(3)根据氮原子的价层电子对数判断杂化方式,一个单键就是一个σ键,一个双键中含有一个σ键,一个π键;
(4)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,然后求出比值;根据V=$\frac{m}{ρ}$求得晶胞的体积,进而可求得晶胞边长.
解答 解:(1)As的原子序数为33,电子分四层排布,最外层有5个电子,由构造原理可知电子排布为1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3);
故答案为:1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3);
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键,与CN一互为等电子体的化合物分子式为 CO,
故答案为:配位; CO;
(3)在N=N=O中,边上的氮原子的价层电子对数为$\frac{5+1}{2}$=3,所以是sp2杂化,中间氮原子的价层电子对数为$\frac{5-1}{2}$=2,所以是sp杂化,根据 的结构可知,每个分子中含有10个σ键,所以1mol PAN中含σ键数目为10NA,
的结构可知,每个分子中含有10个σ键,所以1mol PAN中含σ键数目为10NA,
故答案为:sp2、sp;10NA;
(4)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以m:n=12:4=3;根据V=$\frac{m}{ρ}$可知晶胞的体积为$\frac{\frac{4M}{{N}_{A}}}{ρ}$cm3=$\frac{4M}{ρ{N}_{A}}$cm3,所以晶胞边长a=$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm=$\root{3}{\frac{4M}{ρ{N}_{A}}}$×107nm,
故答案为:3;$\root{3}{\frac{4M}{ρ{N}_{A}}}$×107.
点评 本题考查物质的结构与性质,注重对电子排布式、配位键、等电子体、原子杂化方式、晶胞的计算等知识,难度中等,注重基础知识的考查,侧重于考查学生的分析能力和对基础知识的综合应用考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯酚) | A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO | a.蒸馏 b.分液 c.盐析、过滤 d.萃取 | ① | ||
| ②乙醇(水) | ② | ||||
| ③肥皂(甘油、水) | ③ | ||||
| ④乙酸乙酯(乙酸) | ④ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学式为CF2Cl2的物质可以看作是甲烷的衍生物,它有两种分子结构 | |
| B. | 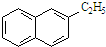 所有原子都处于同一平面 所有原子都处于同一平面 | |
| C. | C3H8O有2种同分异构体 | |
| D. | 甲苯的二氯代物共有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图是元素周期表短周期的一部分,A、B两种元素可以形成B2A2,分子中所有原子的最外层电子都达到8个电子的稳定结构.下列说法不正确的是( )
如图是元素周期表短周期的一部分,A、B两种元素可以形成B2A2,分子中所有原子的最外层电子都达到8个电子的稳定结构.下列说法不正确的是( )| A. | B为氧元素A为氟元素 | B. | 该化合物形成的分子式为S2Cl2 | ||
| C. | 该化合物为共价化合物 | D. | B位于元素周期表第15纵行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浊液的分散质都可用过滤的方法从分散剂中分离出来 | |
| B. | 任何物质在水中溶解时都有一定的溶解度 | |
| C. | 同一种溶质的饱和溶液要比不饱和溶液的浓度大一些 | |
| D. | 分散质粒子大小为几纳米到几十纳米的散系是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com