
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
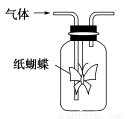
ABCD
喷洒液酚酞紫色石蕊酸性重铬酸钾酸化的KI—淀粉
通入的气体NH3Cl2CH3CH2OH(g)O3
预测的颜色变化变为红色最终褪色无明显变化变为蓝色
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学指导冲关 第2练氧化还原反应和离子反应练习卷(解析版) 题型:选择题
下列对各组离子或物质是否能够大量共存解释正确的是( )
A常温常压下NH3、O2、H2、CO2不能共存NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3
Bc(OH-)=1.0×10-13 mol/L溶液中,Fe2+、NO3—、SO42—、Na+ 不能共存 发生反应:3Fe2++NO3—+4H+=3Fe3++NO↑+2H2O
C溶液中:K+、Cu2+、Cl-、NH3·H2O不能共存发生反应:Cu2++2OH-=Cu(OH)2↓
D溶液中:Al3+、Na+、SO42—、HCO3—可以共存不能发生反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第14练有机物的组成、结构和性质练习卷(解析版) 题型:选择题
与CH2=CH2―→CH2Br—CH2Br的变化属于同一反应类型的是( )
A.CH3CHO―→C2H5OH
B.C2H5Cl―→CH2=CH2
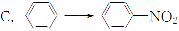
D.CH3COOH―→CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第12练物质制备方案的设计与评价练习卷(解析版) 题型:实验题
乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。
(1)请写出乙二酸受热分解的化学方程式______________________。
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。

请你按整套装置从左至右的顺序填写下表中的空格:
仪器符号 | 仪器中所加物质 | 装置作用 |
B |
|
|
C |
|
|
C | 氢氧化钠浓溶液 |
|
C |
|
|
D |
|
|
E |
|
|
(3)上述实验中能说明乙二酸受热分解生成了还原性气体的实验现象是________________________________________________________________。
(4)检验乙二酸具有较强的还原性,通常选用的试剂是_______________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第11练化学实验基础知识练习卷(解析版) 题型:填空题
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
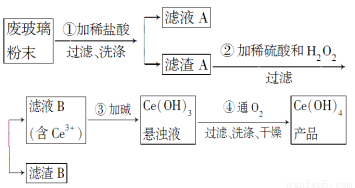
(1)洗涤滤渣A的目的是为了去除________(填离子符号),检验该离子是否洗净的方法是___________________________________________________。
(2)第②步反应的离子方程式是__________________________________,滤渣B的主要成分是________。
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定终点(铈被还原为Ce3+),消耗25.00 mL标准溶液,该产品中Ce(OH)4的质量分数为________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第11练化学实验基础知识练习卷(解析版) 题型:选择题
用下列实验装置进行相应实验,能达到实验目的的是( )

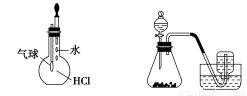
甲 乙 丙 丁
A.装置甲:除去乙烯中混有的少量SO2
B.装置乙:用浓硫酸配制1 mol/L的硫酸
C.装置丙:检验HCl气体在水中的溶解性
D.装置丁:用铜和浓硝酸反应制取NO2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第10练常见有机化合物及其应用练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.一定条件下可以用H2除去乙烷中混有的乙烯
B.苯和四氯化碳都能萃取溴水中的溴
C.乙醇、乙酸和乙酸乙酯三者的混合液可用分液的方法分离
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(二) (解析版) 题型:填空题
能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0 kJ/mol
Ⅱ.CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。
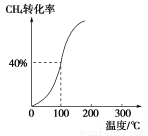
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________;
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将1.0 mol CO与2.0 mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的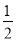 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时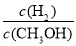 减小
减小
E.平衡常数K增大
(4)工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是:___。
CO(g)+2H2(g),此反应能自发进行的原因是:___。
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
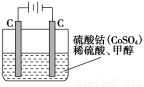
①写出阳极电极反应式_______________;
②写出除去甲醇的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
某酸性溶液可能含有Br-、SO42-、H2SO3、NH4+等,分别对该溶液进行如下实验:
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列物质不能确定其在原溶液中是否存在的是( )
A.Br- B.SO42- C.H2SO3 D.NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com