
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。人体缺E元素会得软骨病,D与E位于同主族。请根据以上情况,回答下列问题:(答题时,用A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C非金属性由强到弱的顺序为________。E在元素周期表中的位置是_____________。
(2)C的一种氢化物是绿色氧化剂,其电子式是________,
(3)B的氢化物的沸点比它的同族相邻周期元素氢化物的沸点高,理由是_____________。
B的氢化物溶于水的电离方程式为_____________________________________。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是______________________________________________。
【答案】 O>N>C 第四周期ⅡA族 ![]() NH3分子间有氢键,而PH3分子间没有氢键 NH3+H2O
NH3分子间有氢键,而PH3分子间没有氢键 NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH- (或 NH3+H2O
+OH- (或 NH3+H2O![]() NH
NH![]() +OH-) 4Mg+10HNO3=== 4Mg(NO3)2+NH4NO3+3H2O
+OH-) 4Mg+10HNO3=== 4Mg(NO3)2+NH4NO3+3H2O
【解析】(1)同周期自左向右非金属性逐渐增强,则A、B、C非金属性由强到弱的顺序为O>N>C。Ca在元素周期表中的位置是第四周期ⅡA族。(2)C的一种氢化物是绿色氧化剂,是双氧水,其电子式是_![]() ;(3)由于NH3分子间有氢键,而PH3分子间没有氢键,因此N的氢化物的沸点比它的同族相邻周期元素氢化物的沸点高;一水合氨是弱碱,则B的氢化物溶于水的电离方程式为NH3+H2O
;(3)由于NH3分子间有氢键,而PH3分子间没有氢键,因此N的氢化物的沸点比它的同族相邻周期元素氢化物的沸点高;一水合氨是弱碱,则B的氢化物溶于水的电离方程式为NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-;(4)B的最高价氧化物对应的水化物的稀溶液稀硝酸与D的单质反应时,B被还原到最低价,即还原产物是硝酸铵,该反应的化学方程式是4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O。
NH4++OH-;(4)B的最高价氧化物对应的水化物的稀溶液稀硝酸与D的单质反应时,B被还原到最低价,即还原产物是硝酸铵,该反应的化学方程式是4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极。电池工作原理如图所示,下列说法不正确的是

A.充电过程中,N电极附近酸性减弱
B.充电过程中,N电极上V3+被还原为V2+
C.放电过程中,H+由N电极向M电极移动
D.放电过程中,M电极反应为V02++ 2H++e一= V02+ +H20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. “是药三分毒”,必须按医嘱或药物说明书使用药物,防范药物不良反应
B. 使用青霉素时,有些人可以不进行皮肤敏感试验
C. 长期大量使用阿司匹林可预防疾病,没有副作用
D. 对于标记“OTC”的药物,必需在医生指导下使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列变化关系,请回答下列问题:(A~E均分别代表一种物质,框图中的部分产物已略去,如A生成D的同时还有CO2生成)
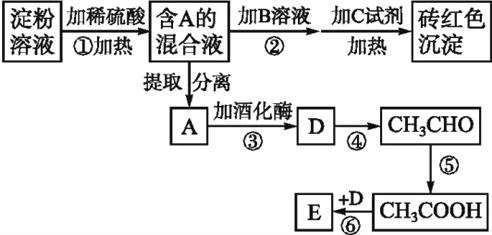
(1)写出A物质的名称____。加B溶液的作用为______________。
(2)写出D的结构简式_________________。
(3)写出下列反应的化学方程式:
③__________________________________。
④__________________________________。
⑥__________________________________。
(4)反应⑥的反应类型是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1 HCl溶液滴定20.00 mL 0.100 0 mol·L-1 NH3·H2O溶液,滴定曲线如下图。下列说法不正确的是

A. ①溶液:c(NH3·H2O)+ c(NH![]() )=2c(Cl-)
)=2c(Cl-)
B. ①溶液:c(NH![]() )+2c(H+)=2c(OH-)+c(NH3·H2O)
)+2c(H+)=2c(OH-)+c(NH3·H2O)
C. ②溶液:c(NH![]() )=c(Cl-)>c(OH-)=c(H+)
)=c(Cl-)>c(OH-)=c(H+)
D. ③溶液:c(NH![]() ) > c(Cl-) > c(H+) > c(OH-)
) > c(Cl-) > c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A.Cl2与水反应:Cl2+ H2O = Cl-+ClO-+ 2H+
B.Fe溶于稀硝酸:2Fe+6H+ = 2Fe3++3H2↑
C.烧碱溶液中加入铝片:2Al+2OH-+2H2O = 2AlO2-+3H2↑
D.在稀氨水中通入过量CO2:2NH3·H2O+CO2 = 2NH4++CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤造成的污染是大气污染的主要原因,利用下列反应可减少燃煤污染:
SO2(g)+2CO(g) ![]() 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
下列有关该反应的判断正确的是( )
A.使用催化剂改变了反应途径,但ΔH没变
B.升高温度,反应速率加快,反应放出的热量增多
C.反应物的化学计量数之和等于生成物的化学计量数之和,故压强对转化率无影响
D.在容积固定的容器中进行反应时,若混合气体的密度不再改变,则该反应不一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮可由NO和O2生成,已知在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)已知:K800 ℃>K1 000 ℃,则该反应的ΔH________0(填“大于”或“小于”),用O2表示0~2 s内该反应的平均速率为________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内气体颜色保持不变
b.2v逆(NO)=v正(O2)
c.容器内压强保持不变
d.容器内气体密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有________。
(4)在题述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=________。
(5)在题述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,NO2的转化率为________。
(6)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
①CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O ΔH<0
2N2(g)+CO2(g)+2H2O ΔH<0
②CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g) ΔH<0
N2(g)+CO2(g)+2H2O(g) ΔH<0
对于反应②,欲提高NO2的转化率,可采取的措施有________。
a.增加原催化剂的表面积
b.降低温度
c.减小投料比[n(NO2)/n(CH4)]
d.增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com