
如图所示,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42—离子物质的量浓度的对数,回答下列问题。

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
(4)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是________(填字母序号)。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
(1)Zn2++4OH-=Zn(OH)42— (2)10-17
(3)8.0~12.0 (4)ABCD
【解析】(1)由图可知:pH在8.0~12.0时,Zn2+主要以Zn(OH)2存在。pH>12.0时,Zn(OH)2转化为Zn(OH)42—。
(2)Ksp=c(Zn2+)·c2(OH-),当pH=7时,c(Zn2+)=10-3 mol·L-1,即Ksp=10-3·(10-7)2=10-17。
(3)由图知,应控制pH范围8.0~12.0。
(4)由表中数据可知,当Cl-浓度由小变大时,PbCl2的溶解度会先变小后变大,说明当Cl-增加到一定浓度时,PbCl2可以与Cl-形成某种离子(如配合物)而增大溶解度。


科目:高中化学 来源:2014年高考化学苏教版总复习5-3微粒间相互作用力与物质多样性练习卷(解析版) 题型:选择题
观察下列模型并结合有关信息进行判断,下列说法错误的是( )
| HCN | S8 | SF6 | B12结构单元 |
结构模 型示意 图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | B的熔点为1873K |
A.HCN的结构式为H—C≡N
B.固态S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属于原子晶体,其结构单元中含有30个B—B键
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-2 食品中的有机化合物练习卷(解析版) 题型:填空题
生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水 。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为 (不用写反应条件),原子利用率是 。
(3)下列属于乙醇的同系物的是 ,属于乙醇的同分异构体的是 。(选填编号)
A.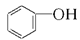
B.
C.乙醚
D.甲醇
E.CH3—O—CH3
F.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
①46 g乙醇完全燃烧消耗 mol氧气。
②乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为 。
③下列说法正确的是 (选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
某有机物的结构简式为: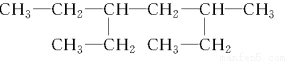 。下列说法不正确的是( )
。下列说法不正确的是( )
A.该有机物属于饱和烷烃
B.该烃的名称是3?甲基?5?乙基庚烷
C.该烃与2,5?二甲基?3?乙基己烷互为同系物
D.该烃的一氯取代产物共有8种
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
利用下列反应不能制得括号中纯净物的是( )
A.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷)
B.乙烯与水加成(乙醇)
C.乙烯与氯气加成(1,2?二氯乙烷)
D.液溴与苯用溴化铁作催化剂反应(溴苯)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
B.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
D.硬水中含有较多的 Ca2+、Mg2+、HCO3—、SO42—,加热煮沸可以完全除去其中的Ca2+、Mg2+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是( )
A.白色沉淀为ZnS,黑色沉淀为CuS
B.上述现象说明ZnS的Ksp小于CuS的Ksp
C.利用该原理可实现一种沉淀转化为更难溶的沉淀
D.该过程破坏了ZnS的溶解平衡
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
等物质的量浓度、等体积的下列溶液中:
①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3、⑤(NH4)2CO3,下列关系或者说法正确的是( )
A.c(CO32—)的大小关系为:②>⑤>③>④>①
B.c(HCO3—)的大小关系为:④>③>⑤>②>①
C.将溶液蒸干灼烧后只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
一定温度下, 在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
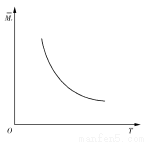
A.温度升高,平衡常数K减小
B.化学计量数a为1
C.维持温度不变,若起始时向容器中加入a mol Z、1 mol W反应达到平衡后放出的热量为Q2 kJ,则Q1+Q2=Q且Q>Q1>Q2
D.X的转化率α=Q1/Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com