
【题目】Ⅰ.煤制天然气的工艺流程简图如下:

(1)反应Ⅰ:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
(2)反应Ⅱ:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH=41 kJ·mol1。如图表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH=41 kJ·mol1。如图表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。

①判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1∶3,则反应Ⅱ应选择的温度是_______(填“T1”或“T2”或“T3”)。
(3)①甲烷化反应Ⅳ发生之前需要进行脱酸反应Ⅲ。煤经反应Ⅰ和Ⅱ后的气体中含有两种酸性气体,分别是H2S和_______。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是__________。
Ⅱ.利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,在能源和环境上的意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0
2H2O(g)+4CO(g) ΔH>0
CH4超干重整CO2的催化转化原理示意如图:

(4)过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
(5)假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程Ⅰ和过程Ⅱ中均含有氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料![]() =1,可导致过程Ⅱ中催化剂失效
=1,可导致过程Ⅱ中催化剂失效
(6)一定条件下,向体积为2 L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的ΔH=________________。
2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的ΔH=________________。

【答案】(15分,除标明外,每空2分)
(1)氧气与碳发生燃烧反应放热,放出的热被可逆反应吸收利用,促进反应正向移动
(2)①T1 <T2<T3 ②T3
(3)①CO2(1分) ②![]() +H2S
+H2S![]() HS +
HS +![]()
(4)4H2+Fe3O4![]() 3Fe+4H2O
3Fe+4H2O
(5)ac
(6)+330 kJ·mol1
【解析】Ⅰ、(1)C(s)+H2O(g)![]() CO(g)+H2(g) △H=+135 kJ·mol1,是吸热反应,而碳与氧气反应放出热量,使反应C(s)+H2O(g)
CO(g)+H2(g) △H=+135 kJ·mol1,是吸热反应,而碳与氧气反应放出热量,使反应C(s)+H2O(g)![]() CO(g)+H2(g),向正反应方向移动,提高碳的利用率;
CO(g)+H2(g),向正反应方向移动,提高碳的利用率;
(2)①反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=41 kJ·mol1的正反应为放热反应,温度越高,一氧化碳的转化率越低,由图可知,温度的大小为:T1<T2<T3;
CO2(g)+H2(g) △H=41 kJ·mol1的正反应为放热反应,温度越高,一氧化碳的转化率越低,由图可知,温度的大小为:T1<T2<T3;
②若煤气化反应Ⅰ发生后的汽气比为0.8,设水蒸气的物质的量是4 mol、则生成的CO物质的量为5 mol,同时生成5 mol氢气,经煤气化反应Ⅰ和水气变换反应Ⅱ后,设反应Ⅱ中CO转化的为x mol,则生成x mol氢气,则(5x)∶(5+x)=1∶3,x=2.5,CO的转化率=![]() ×100%=50%,根据图知,反应温度为T3;
×100%=50%,根据图知,反应温度为T3;
(3)①根据方程式Ⅱ知,生成的酸性气体还有二氧化碳;②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,则二者反应生成碳酸氢钾和硫氢化钾,反应方程式为K2CO3+H2SKHS+KHCO3;
Ⅱ、(4)由图示可知,过程Ⅱ中氢气还原Fe3O4生成H2O,发生反应的化学方程式是4H2+Fe3O4![]() 3Fe+4H2O;
3Fe+4H2O;
(5)假设过程Ⅰ和过程Ⅱ中的各步均转化完全,a.过程Ⅰ有氢气生成,而过程Ⅱ中存在氢气还原四氧化三铁和CO还原四氧化三铁,均属于氧化还原反应,故a正确;b.过程Ⅱ中使用的催化剂为Fe3O4和CaO,故b错误;c.若过程Ⅰ投料![]() =1,则CH4和CO2恰好生成CO和H2,无多余的CO2,导致过程Ⅱ中只能生成FeO,催化剂效果降低,故c正确;答案为ac;
=1,则CH4和CO2恰好生成CO和H2,无多余的CO2,导致过程Ⅱ中只能生成FeO,催化剂效果降低,故c正确;答案为ac;
(6) CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g)
起始物质的量(mol) 1.2 4.8 0 0
变化物质的量(mol) x 3x 2x 4x
平衡物质的量(mol) 1.2 x 4.83x 2x 4x
平衡时CH4的体积为![]() =
=![]() ,解得x=0.36 mol,则ΔH=+118.8×
,解得x=0.36 mol,则ΔH=+118.8×![]() kJ·mol1=+330 kJ·mol1。
kJ·mol1=+330 kJ·mol1。


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.5 L的恒容密闭容器中发生反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
Ⅱ | 607 | 0.22 | 0.82 | / | |
Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10-3 |
下列说法正确的是
A.该反应正反应为放热反应
B.607 K时该反应的平衡常数2.50×10-2
C.容器Ⅱ达到平衡时容器中COS的物质的量大于0.02 mol
D.容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A. 四卤甲烷晶体的熔点由低到高:CF4<CCl4<CBr4<CI4
B. 熔点由高到低:Na>Mg>Al
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞之所以能进行各种生命活动,是因为有其自身的物质基础和结构基础。图1是细胞内两类生物大分子化合物(C和D)的组成层次及功能,请分析回答:

(1)写出生物大分子C的名称 。
(2)写出X和Y所代表的元素符号:X ,Y 。
(3)若图Ⅱ表示J物质的基本组成单位:则J物质是 ,一般为双螺旋结构,主要分布于 中。图Ⅱ的名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了![]() a mol,B的物质的量减少了
a mol,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,v(A)=________,v(B)=________。
(2)化学方程式中,x=________,y=________,p=________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某蛋白质分子的结构示意图,图中α链由21个氨基酸组成,β链由19个氨基酸组成,图中“-S-S-”是在蛋白质加工过程中由两个“-SH”脱下2个H形成的。下列有关叙述中,错误的是( )
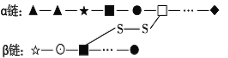
A.蛋白质多样性的原因包括氨基酸的排列顺序不同
B.该蛋白质含有40种氨基酸
C.该蛋白质分子中至少含有42个O原子
D.形成该蛋白质分子时相对分子质量减少了686
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。如图是某课题组设计的液体燃料电池示意图。下列有关叙述不正确的是

A. 该电池的优点是不产生污染气体,且液体燃料便于携带
B. 电池内部使用的是阴离子交换膜,OH-经交换膜移向负极
C. 该燃料电池的电极材料采用多孔纳米碳材料(如图),目的是增大接触面积,增加吸附量
D. 该电池中通入N2H4的电极为正极,发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示某化学反应前后相关物质的结构变化,据图分析,下列说法正确的是( )

A.在化学反应过程中物质A可以为物质B提供活化能
B.物质A在细胞内合成,且只能在细胞内发挥作用
C.若物质B为二糖,则物质C和D分别为葡萄糖和果糖
D.物质A和物质B的水解产物可能相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com